высота по ГОСТ, ширина, маркировка, цены
Размеры фундаментных блоков зависят от принадлежности изделий к одному из нормированных сортаментов. Ведь сборное основание возводится только из стандартных элементов, размеры которых обязаны соответствовать друг другу. В ином случае строительство фундамента будет попросту невозможным.
В данной статье мы приведем примеры типоразмеров таких стандартных блоков, коснувшись разновидностей сортамента подобной продукции. Эта информация заинтересует как заказчиков, так и исполнителей строительных работ, ориентированных на сооружение сборного фундамента.
Сортамент фундаментных блоков
Типовой ГОСТ на изготовление фундаментных блоков – 13579-78 – утверждает, что сортамент подобной продукции состоит из трех оригинальных изделий:
- Сплошного фундаментного блока (ФБС).
- Сплошного блока с вырезом под монтаж коммуникаций, балок и прочих элементов (ФБВ).
- Пустотелого фундаментного блока (ФБП).

Однако этот нормативный документ описывает лишь «стеновые» блоки, которые используются для возведения ленты фундамента или стены жилого цоколя.
Еще один ГОСТ – 13580-85 – утверждает, что к сортаменту бетонных блоков для сборного основания следует причислить и так называемые «плиты для ленточных фундаментов», маркируемые литерами «ФЛ». Эти изделия используются в процессе сборки подошвы ленточного фундамента — блоки ГОСТ 13579-78 монтируют именно на такие основания.
Кроме двух вышеописанных гостов к сортаменту фундаментных блоков, с некоторой натяжкой, можно отнести и продукцию, изготавливаемую по ГОСТ 28737-90. Этот нормативный документ стандартизирует формы и процесс изготовления особых фундаментных балок (БФ) – изделий, применяемых в процессе сооружения ростверка столбчатого или свайного основания.
Таким образом, сортамент изделий, претендующих на отношение к фундаментным блокам, состоит из пяти вышеупомянутых единиц.
Габариты фундаментных блоков
И очерчивающие фундаментные блоки размеры, и цена подобной продукции зависят от принадлежности к конкретной единице сортамента. Ведь тот же блок БФ отличается от блока ФЛ не только стоимостью и габаритами, но и самой формой изделия. Поэтому, рассматривая габариты блоков, следует оттолкнуться именно от принадлежности изделия к конкретной единице сортамента.
Ведь тот же блок БФ отличается от блока ФЛ не только стоимостью и габаритами, но и самой формой изделия. Поэтому, рассматривая габариты блоков, следует оттолкнуться именно от принадлежности изделия к конкретной единице сортамента.
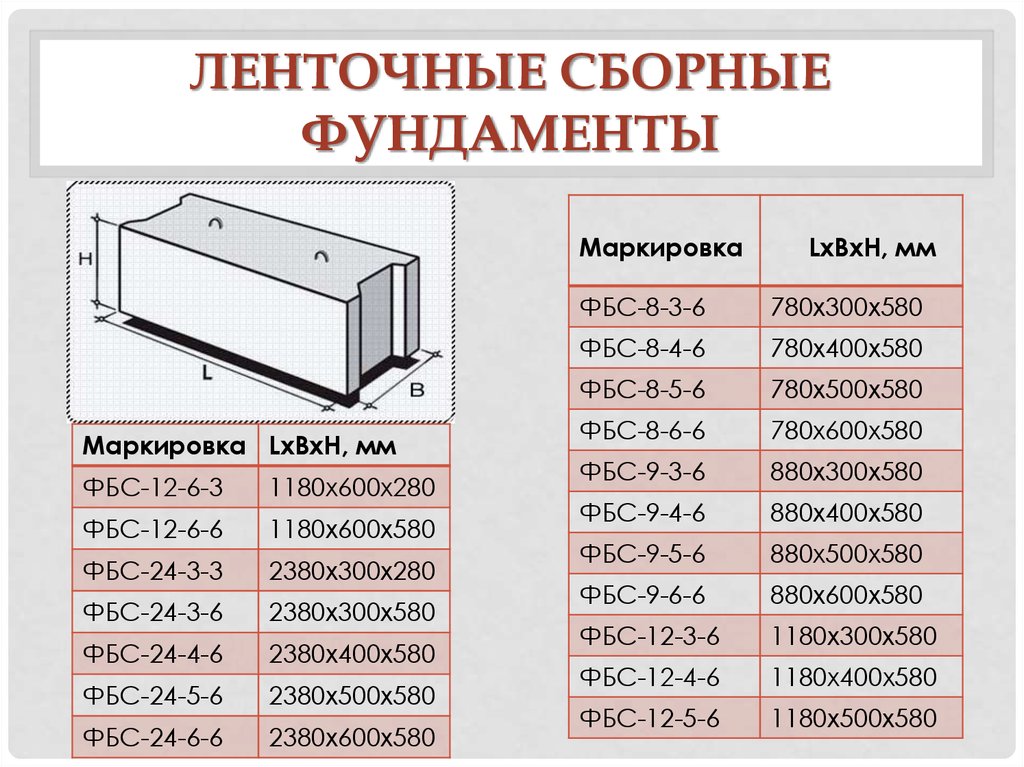
Размеры ФБС блоков
Стандартизированный сортамент таких блоков состоит из 14 типоразмеров изделий. Причем главной размерной характеристикой ФБС блоков является их ширина, а второстепенными – высота и длинна.
По длине сортамент блоков разбит на три типоразмера с габаритами в 2380, 1180 и 880 миллиметров. По высоте сортамент разбит на две группы: 580-миллиметровые блоки и 280-миллиметровые изделия. Причем высота фундаментного блока в 280 миллиметров встречается только у изделий длиной 1180 миллиметров.
Ширина разделяет сортамент блоков на четыре типоразмера с габаритами от 300 до 600 миллиметров (с шагом деления в 100 миллиметров).
В итоге, самый маленький блок ФБС типа имеет габариты 880х300х580 миллиметров (длина, высота, ширина).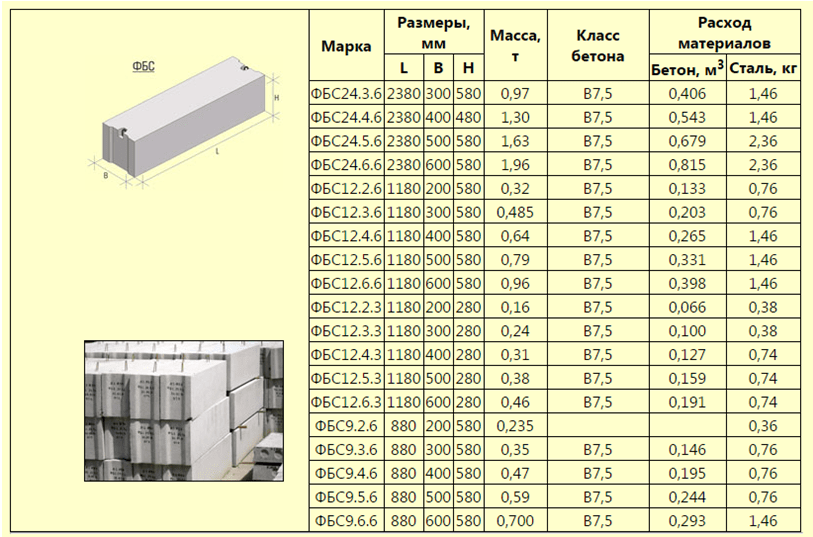 Ну а самый большой блок укладывается в габариты 2380 х 600 х 580 миллиметров.
Ну а самый большой блок укладывается в габариты 2380 х 600 х 580 миллиметров.
Размеры ФБВ изделий
Габариты изделий ФБВ типа сходны с размерами вышеописанного блока. Ведь оба продукта стандартизированы по одному и тому же ГОСТу (13579-78).
Только сортамент ФБВ блока укладывается в три типоразмера, отличающихся друг от друга лишь шириной (40, 50 или 60 сантиметров):
- Высота ФБВ блока всегда равна 58 сантиметрам.
- Длина – 88 сантиметрам.
Габариты ФБП блоков
Сортамент пустотелого блока укладывается в три типоразмера, отличающихся друг от друга шириной. Этот параметр у ФБП блока равен 400, 500 или 600 миллиметрам. Ну а длина таких изделий всегда одинакова – 2380 миллиметров, как и ширина 580 миллиметров.
Габариты БФ изделий
Сортамент изделий БФ типа состоит из 53 типоразмеров. Причем такие блоки отличаются друг от друга и габаритами и формой. По эти параметрам сортамент разделен на шесть разновидностей изделий, из которых три балки имеют тавровую форму, две балки имеют форму поперечного сечения в виде обычной трапеции и сечение еще одной балки имеет форму вытянутой трапеции с удвоенной высотой. Особенности формы профиля отражают цифровые маркировки блоков для фундамента – БФ1, БФ2 и так далее
Особенности формы профиля отражают цифровые маркировки блоков для фундамента – БФ1, БФ2 и так далее
Причем каждый из шести типоразмеров изготавливается со своими габаритами поперечного сечения (верх, низ, высота): от 200х160х300 миллиметров у БФ1 и до 520х200х300 миллиметров у БФ4. Кроме того, есть и особое изделие с удвоенной высотой – балка БФ6, габариты которой равны 400х240х600 миллиметрам.
А вот длина БФ балок – стандартна. То есть, каждое изделие с уникальным профилем выпускается в виде мерного отрезка длиной от 1,45 до 12 метров. Причем длина четырех типоразмеров — БФ1-БФ4 – изменяется от 1,45 до 6 метров. А типоразмеры БФ5 и БФ6 изготавливаются в виде мерных отрезков в 10,3 и 12 метров.
Размеры ФЛ изделий
Сортамент ленточных блоков состоит из 126 позиций, разделенных на 10 типов изделий с оригинальной шириной опорной части. Этот параметр изменяется с шагом 200-400 миллиметров.
Причем ширина ФЛ блоков колеблется в пределах от 600 до 3200 миллиметров:
- По высоте ФЛ блоки делятся на 300-миллиметровые и 500-миллиметровые изделия.
 Причем полуметровая высота бывает только у блоков с шириной от двух метров.
Причем полуметровая высота бывает только у блоков с шириной от двух метров. - Длина изделия делит сортамент на четыре типоразмера с габаритами от 780 и до 2980 миллиметров.
В итоге, самый большой блок ФЛ типа укладывается в габариты (ширина, высота, длина) 3200х500х1180 миллиметров, хотя бывают и изделия на 2000х500х2980 миллиметров. Ну а самым маленьким блоком является изделие с габаритами 600х300х1180 миллиметров.
Размеры блоков ФБС для фундамента: разновидности и размерность
В тех случаях, когда необходимо возвести ленточное основание в минимальный отрезок времени, вам потребуются блоки ФБС для фундамента. Они представляют собой одну из разновидностей ж/б изделий, которые нашли своё применение при установке сборных строений из ФБС. Необходимы фундаментные блоки сплошные (так расшифровывается аббревиатура ФБС) для постройки фундаментных стен. Сегодня речь пойдёт о том, какие существуют размеры блоков фбс для фундамента, их сортамент и основные особенности, и нюансы, связанные с их применением.
Необходимы фундаментные блоки сплошные (так расшифровывается аббревиатура ФБС) для постройки фундаментных стен. Сегодня речь пойдёт о том, какие существуют размеры блоков фбс для фундамента, их сортамент и основные особенности, и нюансы, связанные с их применением.
По своей форме сплошной фундаментный блок является параллелепипедом прямоугольной формы, который отливают из бетона. На торцах изделия выполнены выемки прямоугольной формы. Они сделаны для того, чтобы облегчить процесс заливки шва при монтаже. Обычно ФБС-блоки производятся на заводах, выпускающих железобетонные изделия. Их производство предусматривает применение технологии вибрационного прессования. Спрессовать цельное изделие можно только в условиях заводских стендов, поскольку конструкции ФБС могут достигать вес около полутора тонн.
Разновидности конструкций
По своему сортаменту такая конструкция различается по разнообразным критериям. Сюда относится классификация по виду применяемой в производстве арматуре, а также по разновидности раствора, используемом в процессе заливки железобетонных изделий.
Если исходить из классификации по первому критерию, то виды блоков фбс подразделяются на:
- Продукцию с каркасом напряженного типа. Он производится из арматурных элементов растянутого или закаленного вида.
- Продукцию с каркасом ненапряженного типа. Изготавливается такой вид из арматуры, не подверженной обработке.
Стоит отметить также и то, что в обеих ситуациях используется стальная арматура, в основу которой вошла марка А1 либо А111.
Если исходить из типа бетонных блоков, то они различаются по второму критерию на следующие разновидности:
- Железобетонная продукция, при изготовлении которой использовался тяжелый бетон. В его основу пошел раствор, марка которого М250 или М300. Также нередко используется раствор, имеющий марку М400.
- Ж/б продукция, выполненная из бетона лёгкого типа. Она производится из растворов марки В150. Здесь же актуальным является использование и не менее популярной марки В100.
- Железобетонные конструкции, выполняемые из керамзитобетона, которые производились из специализированного раствора, в его основу положен керамзит гранулированного типа.
 Он играет в нём роль своеобразного армирующего наполнителя.
Он играет в нём роль своеобразного армирующего наполнителя.
От того, к какой из групп относится то или иное изделие, зависит, какие размеры блоков бывают, а также какой может быть вес и их стоимость, что, скорее, является следствием из вышеперечисленных признаков.
Преимущества и недостатки рассматриваемых конструкций
Современные блоки ФБС обладают массой преимущественных характеристик. К их числу можно отнести следующие:
- Отличная несущая способность изделия, которую можно сравнить со свойствами монолита литого типа.
- Прекрасная устойчивость к разного рода вредным воздействиям окружающей среды. Блок, который был предварительно спрессован на специализированном вибростенде, отличается двумя ключевыми характеристиками. Сюда можно отнести наименьшую пористость и высокую поверхностную твёрдость. Проще говоря, к минимуму снижается возможность заплесневения внутренней структуры ФБС блока.
- Также к числу достоинств можно отнести и крупногабаритность изделий.
 Объясняется это тем, что становится возможным ускорение хода возведения фундамента. Самым большим блоком ФБС для основания является такое изделие, которое по своим параметрам способно заполнить практически одну четвёртую часть десятиметровой стены, выполненные из ленточного основания. Таким образом, с целью возведения фундамента мелкозаглублённого типа потребуется наличия всего лишь на всего шестнадцати единиц рассматриваемого изделия. В том случае, если основание планируется погрузить глубоко, то его необходимо будет сложить из тридцати двух блоков. Они складываются из двух рядов.
Объясняется это тем, что становится возможным ускорение хода возведения фундамента. Самым большим блоком ФБС для основания является такое изделие, которое по своим параметрам способно заполнить практически одну четвёртую часть десятиметровой стены, выполненные из ленточного основания. Таким образом, с целью возведения фундамента мелкозаглублённого типа потребуется наличия всего лишь на всего шестнадцати единиц рассматриваемого изделия. В том случае, если основание планируется погрузить глубоко, то его необходимо будет сложить из тридцати двух блоков. Они складываются из двух рядов.
Однако у рассматриваемых блоков ФБС есть и некоторые слабые стороны. Необходимо перечислить и их:
- Крупный вес продукции, который обуславливают размеры блоков фбс для фундамента. Если поискать и найти самый маленький фундаментный блок, то его вес будет составлять не одну сотню килограмм. Всё это ведёт к необходимости использования тяжёлой строительной техники при установке фундаментных стен из ФБС.

- Не хватает кладке из таких блоков и показателей герметичности. В фундаментных стенах есть некоторые уязвимые места, которые базируются в кладочных швах. Из-за своих физических характеристик они склонны к притягиванию грунтовых вод. Однако эта проблема поддаётся устранению. Для этого всегда внешняя часть изделия оснащается надёжным гидроизоляционным слоем.
- Также недостаточны показатели теплостойкости. Справедливости ради отметим, что этот «минус» характеризует также и заливку ленточного типа.
Кроме всего прочего, к числу слабых сторон можно отнести ещё одну, которая заключается в некоторой дороговизне, которая присуща процессу возведения фундамента из подобного рода блоков. Так, к примеру, такие конструкции могут обойтись примерно на треть дороже, нежели ленточный фундамент.
Размерность изделия
В этом разделе рассмотрим, какие размеры блоков использовать для фундамента. Габаритная составляющая определяется исходя из специального нормативного документа. Им является государственный стандарт – ГОСТ. Изложены здесь не только основные параметры продукции, а также и некоторые отклонения от них, которые возможны и допустимы. Исходя из параметров длины изделия, оно классифицируются на три разновидности.
Им является государственный стандарт – ГОСТ. Изложены здесь не только основные параметры продукции, а также и некоторые отклонения от них, которые возможны и допустимы. Исходя из параметров длины изделия, оно классифицируются на три разновидности.
Габариты продукции могут составлять 9, 12 и 24 дм. Что касается критерия высоты, то здесь также имеет места классификация, только уже на два типа – 3 и 6 дм. Согласно показателям ширины, данная разновидность железобетонных изделий классифицируется на 4 типа, среди которых продукция представлена с данным параметром от 3х до 6ти дм.
Также, кроме всего вышеперечисленного, имеет место продукция, изготавливаемая исходя из отраслевых нормативов. Благодаря ним становится возможным возведение основания с нестандартными параметрами.
Установка сборного фундамента
Устанавливаются бетонные блоки фбс в несколько этапов, причём в рамках первого осуществляется разметка и рытьё котлована. Следует отметить, что подобные изделия подразумевают под собой традиционный котлован, имеющий выемку прямоугольного типа. Что касается осуществления разметки, то она выполняется с использованием проволоки. Понадобиться могут также и вехи, с помощью которых очерчивается высшая граница разрабатываемого котлована. Параметры её обычно превышают соответствующие габариты основания на глубину заложения фундаментной подошвы.
Что касается осуществления разметки, то она выполняется с использованием проволоки. Понадобиться могут также и вехи, с помощью которых очерчивается высшая граница разрабатываемого котлована. Параметры её обычно превышают соответствующие габариты основания на глубину заложения фундаментной подошвы.
Данный этап, в рамках которого осуществляются земляные работы, оканчивается тем, что необходимо засыпать песчаную подушку. Выполняется эта операция на дне траншеи, которая была предварительно обустроена по периметру котлована. Что касается габаритов выемки, то они должны быть идентичны габаритам фундаментной подошвы. В данном случае имеется в виду ширина.
Далее сборка основания осуществляется по следующей схеме:
- Поверх песчаной подушки укладывают рубероидную ленту;
- Далее устанавливается ФЛ блок;
- Поверх него устанавливается ряд блоков ФБС.
 При укладке сплошных блоков используется принцип «от угла к центру». Швы должны быть заполнены посредством специализированного скрепляющего раствора.
При укладке сплошных блоков используется принцип «от угла к центру». Швы должны быть заполнены посредством специализированного скрепляющего раствора. - После этого укладывается следующий блочный ряд. Его необходимо монтировать согласно принципу кирпичной кладки. Он заключается в том, чтобы вышестоящая единица продукции обосновывалась на двух нижележащих. Таки образом, вертикальный шов будет перекрыт центром верхнего изделия.
- По окончанию установки стенок, на верхние грани последнего блочного ряда заливается ростверк монолитного типа.
Если вы не будете пренебрегать основными правилами, то всё завершится успешно. В данной статье мы постарались рассказать вам о том, какие блоки фбс бывают, их параметры, слабые и сильные стороны, а также описали процесс установки. Надеемся, что эти знания окажутся полезными для вас. Успешного строительства!
Блоки ФБС. Размеры и способы монтажа на стройке
Блоки ФБС (Фундаментные стеновые блоки) от компании «Строитель-М» это изделия из тяжелого бетона класса В15. ФБС предназначены для возведения сборных фундаментов, стен подвалов, цоколей домов.
ФБС предназначены для возведения сборных фундаментов, стен подвалов, цоколей домов.
Размеры ФБС по ГОСТ 13579-78.
«Строитель-М» выпускает бетонные блоки длиной 2380 мм при высоте 580мм. Варьируется только ширина: 300, 400, 500, 600 мм. Отклонения от гостовских размеров не превышают ±13 мм по длине и ±5 по высоте и ширине. Точные геометрические размеры позволяют избежать погрешностей при строительстве. Внушительные размеры и вес элементов подразумевают их монтаж только подъемной техникой, при наличии удобного подъезда к объекту.
Варьируется только ширина: 300, 400, 500, 600 мм. Отклонения от гостовских размеров не превышают ±13 мм по длине и ±5 по высоте и ширине. Точные геометрические размеры позволяют избежать погрешностей при строительстве. Внушительные размеры и вес элементов подразумевают их монтаж только подъемной техникой, при наличии удобного подъезда к объекту.
Особенности монтажа
Перед поднятием первого блока, убедитесь в том, что опоры крана находятся находятся на достаточном расстоянии от края котлована или траншеи во избежание сползания или осыпания грунта. Если проектные размеры стены не кратны длине ФБС, пустые промежутки можно заполнять бетонной смесью или планировать прохождение в них водоводов и прочих сетей.
Подготовка основанияНа первом этапе разбивают оси на дне готового котлована, заглубленного ниже глубины промерзания (для района Урала это не менее 1,8м). По осям основания натягиваются нити на колышках с соблюдением прямых углов. Прямой угол выдерживается специальным лазерным разметчиком. Далее от осевой нити на расстояние половины ширины блока с припуском до 5см натягивают шнуры, обозначающие внешние грани блочного фундамента.
Далее от осевой нити на расстояние половины ширины блока с припуском до 5см натягивают шнуры, обозначающие внешние грани блочного фундамента.
Если грунт песчаный, монтировать можно прямо на выровненную поверхность. Поперечная ширина песчаного основания должна быть больше опорной части блоков на 20-30 см.
Необходимые инструменты и материалы:
- Комплект блоков с подготовленными для сетей отверстиями;
- строительный кран;
- бетономешалка.
- песок крупной фракции;
- цементобетонная смесь;
- плоская арматурная сетка;
- гидроизоляционные материалы;
- лопата;
- лазерный уровень и отвес;
- бечевка и колышки для разметки;
 В процессе тщательно проверяют горизонтальные и вертикальные уровни. Все швы плотно заполняются цем.раствором. ФБС размещают со смещением швов вразбежку (перевязкой) на расстояние не менее 25-60 см подобно кирпичной кладке с чередованием рядов. Перемещение блоков проводится подъемным краном в присутствии профессионального такелажника. Поверхности изделий заранее очищают от грязи и слегка смачивают для лучшего сцепления с цементным раствором. Минимальная толщина цементной стяжки составляет 15 мм. Вертикальные швы заполняются с двух торцов раствором и уплотняются.
В процессе тщательно проверяют горизонтальные и вертикальные уровни. Все швы плотно заполняются цем.раствором. ФБС размещают со смещением швов вразбежку (перевязкой) на расстояние не менее 25-60 см подобно кирпичной кладке с чередованием рядов. Перемещение блоков проводится подъемным краном в присутствии профессионального такелажника. Поверхности изделий заранее очищают от грязи и слегка смачивают для лучшего сцепления с цементным раствором. Минимальная толщина цементной стяжки составляет 15 мм. Вертикальные швы заполняются с двух торцов раствором и уплотняются.Отверстия под инженерные коммуникации намечают и пробивают в блоках заранее на этапе монтажа. Так же их можно предусмотреть простым горизонтальным смещением фбс-блока. Входы и стыки для сетей обрабатывают гидрофобными составами.
Внешняя гидроизоляцияПо верхнему ряду основания выполняется гидроизоляция. А при наличии повышенной влажности грунтов – дополнительно проводят мероприятия по гидрофобизации наружных поверхностей.
Цена фундамента
В финансовом плане монтаж фундамента из ФБС — наиболее экономичен. Подсчитать расходы на стройматериалы несложно. И, хотя 1 куб. блоков-ФБС стоит несколько дороже куба бетона, вы сэкономите на опалубке и арматуре. Земляные работы в любом случае одинаковы. Узнать цены и Заказать ФБС можно ЗДЕСЬ
Фундамент дома из ФБС. Если строите дом, то бетонные блоки ФБС — идеальный вариант фундамента дома.
Бетонный блок ФБС, пожалуй, самый распространенный вариант для строительства фундамента дома. И чаще всего используется сплошной бетонный фундаментный блок, обозначаемый аббревиатурой ФБС. Их используют для монтажа фундаментов домов под наружные и внутренние несущие стены.
Кроме того, бетонные блоки используют для сооружения подпорных стенок, пандусов, заборов, платформ и эстакад.
В производстве фундаментных блоков сплошных (ФБС) предприятие «Строитель-МП» применяет Технические условия производства, типовые размеры и прочностные характеристики, регламентируемые Государственным стандартом № 13579 от 1978 года.
Преимущества бетонных блоков для фундамента
- Значительное снижение сроков строительных работ, чем при заливке монолитного фундамента дома. Мы, кстати оказываем услугу по заливке монолита собственным бетононасосом 21 куб.м.;
- Стандартные размеры блоков позволяют быстро и точно рассчитать нужное количество ФБС;
- Нет необходимости в дорогостоящей опалубке, добавках против замерзания бетона;
- Долговечность сборного фундамента более 100 лет (при правильном монтаже и соблюдении условий эксплуатации).
размеры и цены 2400х600х400 фундаментные
| ФУНДАМЕНТНЫЕ БЛОКИ | Длина,мм. | Ширина,мм. | Высота,мм. | Вес,тн. | Цена без доставки |
|---|---|---|---|---|---|
| ФБС 24-6-6т | 2380 | 600 | 580 | 1,96 | 2 610,00 |
| ФБС 24-5-6т | 2380 | 500 | 580 | 1,63 | 2 115,00 |
| ФБС 24-4-6т | 2380 | 400 | 580 | 1,3 | 1 701,00 |
| ФБС 24-3-6т | 2380 | 300 | 580 | 0,97 | 1 287,00 |
| ФБС 12-6-6т | 1180 | 600 | 580 | 0,96 | 1 395,00 |
| ФБС 12-5-6т | 1180 | 500 | 580 | 0,79 | 1 147,50 |
| ФБС 12-4-6т | 1180 | 400 | 580 | 0,64 | 940,50 |
| ФБС 12-3-6т | 1180 | 300 | 580 | 0,49 | 733,50 |
| ФБС 9-6-6т | 880 | 600 | 580 | 0,7 | 1 071,00 |
| ФБС 9-5-6т | 880 | 500 | 580 | 0,59 | 882,00 |
| ФБС 9-4-6т | 880 | 400 | 580 | 0,47 | 729,00 |
| ФБС 9-3-6т | 880 | 300 | 580 | 0,35 | 567,00 |
Виды фундаментов
Прочность строения зиждется на фундаменте, поэтому ошибки здесь недопустимы, равно как и использование некачественных материалов и конструкций. Все фундаменты подразделяются на следующие виды:
Все фундаменты подразделяются на следующие виды:
- Монолитные;
- Свайные;
- Плавающие;
- Сборные.
Монолитные и свайные фундаменты обладают наибольшей несущей способностью, их можно устраивать на любых типах грунтов. Плавающие и сборные фундаменты используются в индивидуальном и малоэтажном (до 5-ти этажей) строительстве. В таких ситуациях блоки фундаментные ФБС незаменимы. Монолитные и сборные фундаменты относятся к конструкциям ленточного типа, но в первом случае для достижения требуемой прочности фундамент выдерживается в течение месяца – а это длительный простой.
Маркировка фундаментных блоков
Для маркировки фундаментных блоков используются буквенные обозначения «Ф» или «ФБС», а цифровые символы после них указывают на размеры изделий, им и соответствует цена. Например, маркировка фундаментный блок ФБС 24.6.6 означает изделие длиной 2400 мм, шириной и высотой по 600 мм. В таблице представлены данные в следующем порядке «блок ФБС 2400х600х400 цена» — это размеры блока ФБС 24. 6.3 в миллиметрах. Стандартные габариты блоков (по ГОСТ) составляют:
6.3 в миллиметрах. Стандартные габариты блоков (по ГОСТ) составляют:
- Длина – 900, 1200 и 2400 мм;
- Ширина – 300, 400, 500 и 600 мм;
- Высота – 300 и 600 мм.
Оснастка, в которой формуют блоки ГОСТ размера, позволяет изготавливать укороченные изделия. Кроме того для нужд индивидуальных застройщиков предприятия выпускают блоки нестандартные (уменьшенные), которые используются, в основном, для строительства внутренних перегородок, гаражей и хозяйственных построек. В нашей компании можно всегда выгодно приобрести блоки 20х20х40 — лучшее предложение за счет отсутствия посредников.
Купить блоки в Москве с доставкой от производителя
ФБС формуют в металлической оснастке с откидными бортами. Армирование изделия должно иметь защитный слой бетона толщиной не менее 20 мм, поэтому арматурные сетки укладываются в форму на прокладки. Блоки ФБС, купить которые можно с доставкой, изготавливают из тяжелого бетона, имеющего марку (М) не ниже 200, морозостойкость (Мрз) не менее 50 и водостойкость (В) – не менее 4 единиц. Эти параметры бетона определяют его прочность и устойчивость к внешним воздействиям.
Эти параметры бетона определяют его прочность и устойчивость к внешним воздействиям.
Качество бетона (прочность, рецептура) контролируется в лаборатории производителя. Геометрические размеры изделий проверяются по состоянию металлической оснастки, в которой они формуются. Быстрое созревание бетона обеспечивается помещением изделий в пропарочные камеры. Если вы хотите купить блоки ФБС надлежащего качества – обращайтесь в проверенные компании, которые могут это документально подтвердить.
Использование фундаментных блоков и основные правила устройства фундаментов
Фундамент несет на себе всю тяжесть здания, поэтому для определения его конструкции необходимо точно знать состояние и тип грунта на месте строительства, а также проектную массу строения с учетом эксплуатационной нагрузки. После этого выполняются расчеты общей нагрузки на фундамент и грунт. Ее регулирование возможно только одним способом – увеличением площади опоры. Изделия не позволяют получить требуемую площадь опоры, нельзя использовать для устройства внешнего контура фундамента без дополнительных конструкций.
Такими конструкциями являются плиты ленточных фундаментов, имеющие большую ширину – 800, 1000, 1200, 1400, 1600, 1800 и 2400 мм, к примеру блок ФБС 2400х600х400, цена которого невысока. Их можно заменить монолитной армированной основой соответствующей ширины и толщиной не менее 40 см. Поскольку внешний контур фундамента определяет его несущую способность и обеспечивает устойчивость строения, к его устройству следует подходить с максимальной ответственностью. Изделия 20х20х40 (200х200х400) отлично подходят для перегородок подвальных помещений и в качестве основы внутренних стен здания, где нагрузки на порядок ниже. Блоки ФБС также используют для возведения цоколей зданий, при строительстве погребов и даже в качестве временных заграждений.
Фундаментные блоки – приобретение, доставка, цены
Минимальные требования к качеству бетона (М, Мрз, В) устанавливаются исходя из умеренных погодных условий (перепады температуры, количество и виды осадков). Соответствующие им изделия и цены дадут нужный результат за разумные деньги, но для полной гарантии и собственного спокойствия лучше всего приобрести изделия с повышенными характеристиками. Дом строится на многие десятки лет и дополнительные траты многократно окупятся.
Дом строится на многие десятки лет и дополнительные траты многократно окупятся.
Типы фундаментных блоков и их классификация
Использование готовых бетонных элементов в строительстве – распространённая практика, которая даёт возможность сократить сроки и стоимость работ. При использовании этой технологии не нужно ждать застывания жидкой смеси, после укладки фундамента можно сразу переходить к возведению стен.
ФБС (фундаментные блоки сплошные) используются для сооружения оснований, стен подвалов, несущих опорных конструкций. Изготовить такие элементы можно только в производственных условиях с применением технологии вибропрессования. Компания-производитель «Мир бетона» предлагает купить блоки ФБС с доставкой по Анапе. Заводские изделия изготавливаются из бетонных смесей высоких марок, имеют чёткую геометрию и ровные грани, что обеспечивает лёгкий монтаж.
Изготовить такие элементы можно только в производственных условиях с применением технологии вибропрессования. Компания-производитель «Мир бетона» предлагает купить блоки ФБС с доставкой по Анапе. Заводские изделия изготавливаются из бетонных смесей высоких марок, имеют чёткую геометрию и ровные грани, что обеспечивает лёгкий монтаж.
Классификация блоков ФБС
Требования к блокам определяет ГОСТ 13579-78. Так как эти элементы предназначены для сооружения фундаментов и других ответственных конструкций, для их изготовления применяют тяжёлые, силикатные, керамзитовые бетоны с показателем плотности не меньше 1800 кг/см3. Согласно нормативам, изделия выпускаются в трёх видах:
- ФБС (сплошные). Изготавливаются из бетона высоких марок, имеют наилучшие прочностные характеристики, предназначены для обустройства ленточных сборных фундаментов.
- ФБВ (с вырезом). Аналог сплошных изделий с продольным вырезом для прокладки коммуникаций и проводов.

- ФБП (пустотные). Имеют направленные вниз квадратные пустоты для уменьшения массы и облегчения процесса укладки. Применяются для возведения менее ответственных конструкций, внутренних стен подвалов.
Стандартом предусмотрено несколько типоразмеров ФБС, которые соблюдаются всеми производителями (чистые размеры по длине и высоте на 2 см меньше, эта величина предусмотрена на стык между элементами):
- длина – 0,9/1,2/2,4 м;
- высота – 0,3/0,6 м;
- ширина – 0,3/0,4/0,5/0,6 м.
ГОСТ допускает выпуск крупногабаритных нестандартных изделий под заказ.
Расшифровка маркировки
Обычно при возведении строений используется несколько типов ФБС-блоков. Чтобы предотвратить появление ошибки при заказе, необходимо составить план раскладки и рассчитать требуемое количество элементов. В буквенно-цифровой маркировке указана вся необходимая информация:
- вид блока;
- размеры в последовательности длина/ширина/высота в дециметрах;
- тип используемого бетона.

Примеры обозначений:
- ФБС-24.3.6 – Т – сплошной, габариты 24*3*6 дм, из тяжёлого бетона;
- ФБП -24.4.6 – С – пустотный, размеры 24*4*6 дм, из силикатного бетона.
В компании «Мир бетона» можно купить разные материалы для индивидуального и промышленного строительства: готовые смеси, растворы, бетонные изделия. Фундаментные блоки 24.3.6 и 24.4.6 – самые востребованные типоразмеры для обустройства ленточных оснований в частном домостроении. Блочные элементы нашего завода имеют высокие показатели влагостойкости, могут применяться на водянистых грунтах. Неограниченный срок службы ФБС позволяет использовать изделия для строительства капитальных сооружений.
Размеры фундаментных блоков (ФБС) / Строительство и технологии / Poligon.By
| Наименование | Длина(L) | Ширина(B) | Высота(H) | Вес |
| Фундаментные блоки 24-3-6 | 2 380 | 300 | 580 | 975 кг |
| Фундаментные блоки 24-4-6 | 2 380 | 400 | 580 | 1 300 кг |
| Фундаментные блоки 24-5-6 | 2 380 | 500 | 580 | 1 630 кг |
| Фундаментные блоки 24-6-6 | 2 380 | 600 | 580 | 1 960 кг |
| Фундаментные блоки 12-3-6 | 1 180 | 300 | 580 | 487 кг |
| Фундаментные блоки 12-4-6 | 1 180 | 400 | 580 | 640 кг |
| Фундаментные блоки 12-5-6 | 1 180 | 500 | 580 | 790 кг |
| Фундаментные блоки 12-6-6 | 1 180 | 600 | 580 | 960 кг |
| Фундаментные блоки 9-3-6 | 880 | 300 | 580 | 350 кг |
| Фундаментные блоки 9-4-6 | 880 | 400 | 580 | 470 кг |
| Фундаментные блоки 9-5-6 | 880 | 500 | 580 | 590 кг |
| Фундаментные блоки 9-6-6 | 880 | 600 | 580 | 700 кг |
| Фундаментные блоки 12-4-3 | 1 180 | 400 | 280 | 310 кг |
| Фундаментные блоки 12-5-3 | 1 180 | 500 | 280 | 380 кг |
| Фундаментные блоки 12-6-3 | 1 180 | 600 | 280 | 460 кг |
| Фундаментные блоки 12-3-3 | 1 180 | 300 | 280 | ??? кг |
Цены в Минске: http://mgb.
 by/media/prices/jelezobetonnie_izdeliya.pdf
by/media/prices/jelezobetonnie_izdeliya.pdfТолько зарегистрированные и авторизованные пользователи могут оставлять комментарии.
Количественная оценка белков бычьего сывороточного альбумина для блокирующих применений
Реферат
Бычий сывороточный альбумин (БСА) — один из наиболее широко используемых белковых реагентов в научном сообществе, особенно для пассивации («блокирования») поверхности в различных биологических анализах. На рынке имеется множество вариантов белка BSA, однако информации о том, какие из них предпочтительнее для блокирующих приложений, недостаточно. Здесь мы провели биофизические и биологические измерения, чтобы количественно сравнить конформационные, адсорбционные и блокирующие свойства белковых реагентов BSA, которые были получены с помощью шести методов очистки.В зависимости от метода наблюдались значительные различия в конформационных и адсорбционных свойствах белков BSA, в основном из-за присутствия стабилизаторов жирных кислот. В свою очередь, мы обнаружили, что белки BSA, не содержащие жирных кислот, обладают более высокой блокирующей способностью по сравнению с белками BSA, стабилизированными жирными кислотами, в биотестах на основе поверхности и наночастиц. Мы критически обсуждаем механистические факторы, лежащие в основе этих различий в производительности, и наши выводы предлагают практическую основу для выбора BSA для блокирующих приложений.
В свою очередь, мы обнаружили, что белки BSA, не содержащие жирных кислот, обладают более высокой блокирующей способностью по сравнению с белками BSA, стабилизированными жирными кислотами, в биотестах на основе поверхности и наночастиц. Мы критически обсуждаем механистические факторы, лежащие в основе этих различий в производительности, и наши выводы предлагают практическую основу для выбора BSA для блокирующих приложений.
Общим элементом биоанализов является необходимость минимизировать неспецифическое связывание биомолекул, чтобы максимизировать специфичность и чувствительность анализа 1, 2 . Для достижения этой цели был разработан широкий спектр реагентов, от сырых материалов, таких как молочные белки, до синтетических наноматериалов, таких как тонко настроенные полимеры, для покрытия целевых поверхностей и минимизации событий неспецифического связывания — функция, которую обычно называют «Блокировка» 3-7 . Среди различных вариантов бычий сывороточный альбумин (БСА) является наиболее широко используемым белковым реагентом для блокирующих применений и имеет несколько практических преимуществ, таких как естественное изобилие, низкая стоимость, хорошо зарекомендовавшие себя методы очистки и широкая доступность. BSA считается золотым стандартом блокирующего реагента во многих биологических анализах, включая твердофазный иммуноферментный анализ (ELISA) 8, 9 , блоты 10, 11 , иммуногистохимия 12, 13 , культура клеток 14 и биосенсоры 15, 16 . Он используется в качестве покрытия для повышения стабильности и биосовместимости наночастиц 17, 18 , а также обычно включается в буферные растворы для предотвращения потери ценных материалов, таких как нуклеиновые кислоты, пептиды и ферменты 19, 20 .
BSA считается золотым стандартом блокирующего реагента во многих биологических анализах, включая твердофазный иммуноферментный анализ (ELISA) 8, 9 , блоты 10, 11 , иммуногистохимия 12, 13 , культура клеток 14 и биосенсоры 15, 16 . Он используется в качестве покрытия для повышения стабильности и биосовместимости наночастиц 17, 18 , а также обычно включается в буферные растворы для предотвращения потери ценных материалов, таких как нуклеиновые кислоты, пептиды и ферменты 19, 20 .
В рамках этой области часто упускается из виду аспект BSA как блокирующего реагента заключается в том, что существует много типов коммерчески доступного BSA, которые различаются по способу выделения белка из бычьей плазмы, которая является его основным естественным источником 21 . Эти различия в обработке связаны с выбором метода фракционирования и использованием химических стабилизаторов, и такие различия могут вызвать значительные различия в эффективности блокирования в биологических анализах, даже при сравнении реагентов BSA от одной и той же компании 22 . Тем не менее, в научной литературе практически нет обсуждения того, какие типы реагентов BSA целесообразно выбрать для блокирующих приложений, особенно с механической точки зрения. В большинстве исследований, связанных с блокированием, в которых изучаются детали механизма, оценивается только один тип BSA и сравнивается адсорбция BSA и вызванные поверхностью конформационные изменения на разных поверхностях 23,24 или исследуются эффекты ионной силы 25 или предварительной обработки BSA 26 .Тем не менее, сравнение белков BSA, полученных с помощью различных методов очистки, остается неизученным, несмотря на то, что это самый большой источник разнообразия вариантов реагентов BSA на рынке. Более того, в большинстве научных публикаций имеется ограниченная информация о типе реагента BSA; компания-поставщик иногда указывается, но каталожный номер реагента указывается редко. Таким образом, выбор реагента BSA для блокирующих приложений в значительной степени остается делом проб и ошибок и лабораторных прецедентов, и создание подтвержденной фактическими данными практической основы для руководства выбором реагента BSA является острой необходимостью.
Тем не менее, в научной литературе практически нет обсуждения того, какие типы реагентов BSA целесообразно выбрать для блокирующих приложений, особенно с механической точки зрения. В большинстве исследований, связанных с блокированием, в которых изучаются детали механизма, оценивается только один тип BSA и сравнивается адсорбция BSA и вызванные поверхностью конформационные изменения на разных поверхностях 23,24 или исследуются эффекты ионной силы 25 или предварительной обработки BSA 26 .Тем не менее, сравнение белков BSA, полученных с помощью различных методов очистки, остается неизученным, несмотря на то, что это самый большой источник разнообразия вариантов реагентов BSA на рынке. Более того, в большинстве научных публикаций имеется ограниченная информация о типе реагента BSA; компания-поставщик иногда указывается, но каталожный номер реагента указывается редко. Таким образом, выбор реагента BSA для блокирующих приложений в значительной степени остается делом проб и ошибок и лабораторных прецедентов, и создание подтвержденной фактическими данными практической основы для руководства выбором реагента BSA является острой необходимостью.
Целью нашего исследования было изучить конформационные, адсорбционные и блокирующие свойства коммерчески доступных реагентов BSA, которые были получены с помощью шести методов очистки, и разработать практическую основу для выбора реагентов BSA для блокирующих применений. Наши результаты дают механистическое понимание, объясняющее, почему определенные типы реагентов BSA предпочтительнее других вариантов, а также очерчивают ключевые функциональные критерии для разработки улучшенных версий BSA и других белковых реагентов для блокирующих приложений.
Результаты
Стратегия оценки
Реагенты BSA широко используются для покрытия целевых поверхностей с целью формирования пассивирующих покрытий, которые минимизируют неспецифическое связывание мешающих биомолекул, которые могут повлиять на показания биологических анализов. Целевая поверхность может быть объемной поверхностью, такой как покровное стекло или полимерная мембрана, или наноструктурированной поверхностью, такой как неорганические наночастицы. На практике экспериментатор будет инкубировать поверхность мишени с водным раствором BSA, в результате чего молекулы белка нековалентно адсорбируются и претерпевают конформационные изменения («денатурацию») на поверхности с образованием тонкопленочного белкового покрытия ( рис.1а ).
На практике экспериментатор будет инкубировать поверхность мишени с водным раствором BSA, в результате чего молекулы белка нековалентно адсорбируются и претерпевают конформационные изменения («денатурацию») на поверхности с образованием тонкопленочного белкового покрытия ( рис.1а ).
a , Обзор основных шагов в протоколах блокировки BSA. (i) Целевая поверхность идентифицируется для покрытия BSA для пассивирования поверхности («блокирования»). (ii) Белки BSA в водном растворе инкубируют с целевой поверхностью. (iii) Белки BSA адсорбируются и денатурируют на целевой поверхности. (iv) Выполняется стадия промывки для удаления слабосвязанных белковых молекул БСА. (v) На поверхности образуется прочно прикрепленный монослой адсорбированных белковых молекул БСА. b , Общая экспериментальная стратегия для анализа свойств реагента BSA. Отобрали серию белковых реагентов БСА, очищенных разными методами, и оценили их конформационные, адсорбционные и блокирующие свойства. Был использован ряд подходов к биофизическим измерениям, основанным на фазах раствора и поверхностно-чувствительных, а также к биотестам на основе поверхности и наночастиц. c , Схема способов очистки для выделения молекул белка BSA из бычьей плазмы.Белки БСА, содержащие жирные кислоты (называемые «жирными»), были получены (1) фракционированием холодного этанола, (2) фракционированием теплового шока и (3) фракционированием холодного этанола с последующим фракционированием тепловым шоком, и эти реагенты обозначены как BSA 1, 2, 3 соответственно. Также были приготовлены не содержащие жирных кислот варианты (называемые «обезжиренными») BSA 1, 2, 3, которые обозначены как BSA 4, 5, 6 соответственно.
Был использован ряд подходов к биофизическим измерениям, основанным на фазах раствора и поверхностно-чувствительных, а также к биотестам на основе поверхности и наночастиц. c , Схема способов очистки для выделения молекул белка BSA из бычьей плазмы.Белки БСА, содержащие жирные кислоты (называемые «жирными»), были получены (1) фракционированием холодного этанола, (2) фракционированием теплового шока и (3) фракционированием холодного этанола с последующим фракционированием тепловым шоком, и эти реагенты обозначены как BSA 1, 2, 3 соответственно. Также были приготовлены не содержащие жирных кислот варианты (называемые «обезжиренными») BSA 1, 2, 3, которые обозначены как BSA 4, 5, 6 соответственно.
Основываясь на этом процессе нанесения покрытия, наша стратегия оценки была сосредоточена на характеристике конформационных, адсорбционных и блокирующих свойств шести коммерческих реагентов BSA, очищенных различными методами ( Рис.1b ). Мы использовали широкий спектр инструментов для измерения фазы раствора и поверхностно-чувствительных биофизических измерений, чтобы охарактеризовать реагенты BSA, а также проводить прикладные испытания биопроб на основе поверхности и наночастиц. Этот подход позволил нам не только напрямую сравнить функциональные характеристики различных реагентов BSA в блокирующих приложениях, но также получить ключевые механистические представления о том, как тонкие различия в конформационных свойствах белков, на которые влияют процессы, задействованные в каждом методе очистки, влияют на адсорбция белка, денатурация, вызванная поверхностью, и, как следствие, блокирующая способность.
Этот подход позволил нам не только напрямую сравнить функциональные характеристики различных реагентов BSA в блокирующих приложениях, но также получить ключевые механистические представления о том, как тонкие различия в конформационных свойствах белков, на которые влияют процессы, задействованные в каждом методе очистки, влияют на адсорбция белка, денатурация, вызванная поверхностью, и, как следствие, блокирующая способность.
Мы выбрали шесть коммерческих реагентов BSA, которые были очищены с помощью трех различных маршрутов фракционирования, без или со стадией удаления жирных кислот ( Рис. 1c и Дополнительная таблица 1 ). Этап фракционирования необходим для отделения BSA от других компонентов сыворотки, и существует два основных варианта: фракционирование холодным этанолом и фракционирование тепловым шоком. Вкратце, фракционирование холодного этанола включает снижение температуры образца примерно до -5 ° C с последующим добавлением этанола и корректировкой pH раствора и ионной силы для выделения белка BSA 27-29 .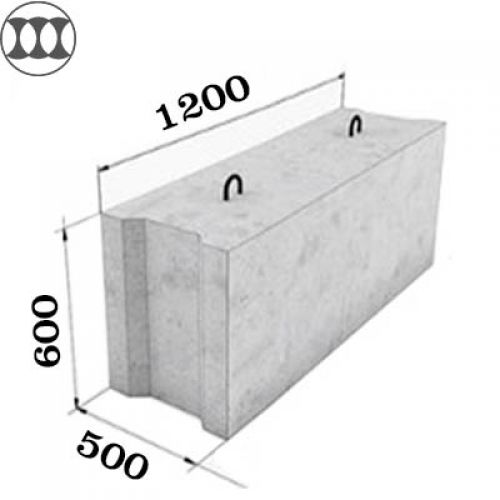 Напротив, фракционирование тепловым шоком включает нагревание образца (обычно до ~ 60 ° C или немного выше) для выделения белка BSA и проводится в присутствии стабилизатора жирной кислоты (каприловая кислота) 30-32 . Эти два процесса фракционирования можно проводить по отдельности или последовательно (холодный этанол, затем тепловой шок).
Напротив, фракционирование тепловым шоком включает нагревание образца (обычно до ~ 60 ° C или немного выше) для выделения белка BSA и проводится в присутствии стабилизатора жирной кислоты (каприловая кислота) 30-32 . Эти два процесса фракционирования можно проводить по отдельности или последовательно (холодный этанол, затем тепловой шок).
После завершения стадии (стадий) фракционирования получают очищенные реагенты BSA. Примечательно, что на этой стадии все реагенты BSA все еще содержат жирные кислоты, которые либо были связаны естественным образом, либо были добавлены в качестве стабилизатора 33 .Мы протестировали реагенты BSA, содержащие жирные кислоты (называемые «жирными»), которые были приготовлены (1) фракционированием холодного этанола, (2) фракционированием теплового шока и (3) фракционированием холодного этанола с последующим фракционированием теплового шока, и эти реагенты обозначены как БСА 1, 2, 3 соответственно. Для удаления жирных кислот требуется дополнительная стадия обработки, которая включает добавление активированного угля с последующим регулированием pH раствора и температуры 34 . Мы также протестировали версии BSA 1, 2, 3 без жирных кислот (называемые «обезжиренными»), и они были обозначены как BSA 4, 5, 6 соответственно.Всего было протестировано шесть различных реагентов BSA, состоящих из трех версий, содержащих жирные кислоты (1-3) и трех версий, не содержащих жирные кислоты (4-6).
Мы также протестировали версии BSA 1, 2, 3 без жирных кислот (называемые «обезжиренными»), и они были обозначены как BSA 4, 5, 6 соответственно.Всего было протестировано шесть различных реагентов BSA, состоящих из трех версий, содержащих жирные кислоты (1-3) и трех версий, не содержащих жирные кислоты (4-6).
Термическая стабильность жирных и обезжиренных белков BSA
Как и другие глобулярные белки, BSA сворачивается в водном растворе, чтобы минимизировать его конформационную свободную энергию. Путь сворачивания продиктован чистым балансом стабилизирующих и дестабилизирующих сил, и результирующая складчатая структура обычно всего на несколько ккал / моль ниже по свободной энергии, чем развернутая аминокислотная цепь 35 .Таким образом, незначительные различия в методах очистки, таких как способ фракционирования, термическая предыстория и содержание жирных кислот, могут иметь важные последствия для конформационной свободной энергии молекул белка БСА. Такие эффекты могут проявляться, влияя на термическую стабильность белков в фазе раствора, а также модулируя профили адсорбции и поверхностной денатурации на целевой поверхности.
В качестве первого шага мы исследовали термическую стабильность различных реагентов BSA путем проведения экспериментов по спектроскопии динамического рассеяния света (DLS) и кругового дихроизма (CD) ( рис.2а ). Эксперименты проводились в измерительных камерах с контролируемой температурой, начиная с 25 ° C, и температура постепенно повышалась с шагом 5 ° C. Метод DLS измеряет распределение белковых молекул по размеру в объеме раствора и может обнаруживать начало вызванной температурой олигомеризации белка, на что указывает заметное увеличение среднего гидродинамического диаметра. Увеличение размера происходит, когда термически денатурированные белковые мономеры повторно собираются в олигомерные структуры 36 .Более высокая начальная температура указывает на большую термическую стабильность и наоборот. С другой стороны, метод спектроскопии КД идентифицирует характеристики вторичной структуры белковых молекул в объеме раствора, и мы отслеживали уменьшение α-спирального характера с увеличением температуры из-за разворачивания белка.
a , Схематическое изображение стратегий измерения спектроскопии DLS и CD.Эксперименты проводились в измерительных камерах с регулируемой температурой, и измерения регистрировались с шагом 5 ° C (в порядке возрастания). b , Гидродинамический диаметр белковых молекул BSA как функция температуры, измеренный в экспериментах DLS. Данные представлены как среднее значение ± стандартное отклонение (s.d.), где s.d. определяется как полная ширина на полувысоте (FWHM) / 2,355 [ n = 5 технических повторений, односторонний дисперсионный анализ (ANOVA) с тестом множественных сравнений Даннета (по сравнению с данными при 25 ° C)] .Точки представляют отдельные точки данных. c , Фракционный процент α-спиральности в молекулах белка BSA как функция температуры, как измерено в экспериментах по спектроскопии КД. Средние значения представлены в верхней части каждого столбца.![]() Значения были рассчитаны на основе данных эллиптичности молярного остатка, и данные представлены как среднее ± стандартное отклонение. ( n = 3 технические реплики). Точки представляют отдельные точки данных. Серая горизонтальная линия на каждом графике соответствует 50% спиральности.
Значения были рассчитаны на основе данных эллиптичности молярного остатка, и данные представлены как среднее ± стандартное отклонение. ( n = 3 технические реплики). Точки представляют отдельные точки данных. Серая горизонтальная линия на каждом графике соответствует 50% спиральности.
В диапазоне температур от 25 до 55 ° C данные DLS показали, что все шесть белков BSA имеют диаметр ∼8 нм, что хорошо согласуется с ожидаемым размером мономеров BSA 25, 26, 37, 38 ( Инжир.2b и (дополнительный рисунок 1 ). При 60 ° C было обнаружено заметное увеличение размеров обезжиренных белков BSA (4-6) со средним диаметром около 20 нм, что указывало на начало олигомеризации белка. Напротив, размеры жирных белков БСА (1-3) оставались стабильными и не увеличивались при 60 ° C. При 65 ° C размеры обезжиренных белков БСА (4-6) увеличивались до диаметра примерно 45 нм, и начало олигомеризации белков происходило для одного из жирных белков БСА (1) со средним диаметром около 35 нм. Напротив, начальные температуры для других жирных белков БСА (2) и (3) составляли 70 и 75 ° C соответственно. Увеличив время инкубации до 2 часов и зафиксировав температуру на уровне 60 ° C, было подтверждено, что обезжиренные белки BSA склонны к более быстрой и обширной олигомеризации, в то время как жирные белки BSA более термостабильны ( Supplementary Fig. 2 ).
Напротив, начальные температуры для других жирных белков БСА (2) и (3) составляли 70 и 75 ° C соответственно. Увеличив время инкубации до 2 часов и зафиксировав температуру на уровне 60 ° C, было подтверждено, что обезжиренные белки BSA склонны к более быстрой и обширной олигомеризации, в то время как жирные белки BSA более термостабильны ( Supplementary Fig. 2 ).
Термоиндуцированная олигомеризация молекул BSA запускается необратимыми конформационными изменениями в структуре белка, когда возникает критическая степень развертывания белка и соответствующая потеря α-спирального характера.Данные спектроскопии КД показали, что все шесть белков БСА проявляли около 60-63% α-спирального характера при 25 ° C, за которым следовало постепенное уменьшение α-спирального характера с повышением температуры 25, 26, 39, 40 ( Рис. 2c и Дополнительные рисунки 3 , 4 ). Как обратимые конформационные изменения (ниже начальной температуры олигомеризации), так и необратимые конформационные изменения (при и выше начальной температуры) способствуют развертыванию белка, поэтому мы сравнили данные спиральности при 65 ° C. Все три образца обезжиренных белков BSA (4-6) имели спиральный процент в среднем ниже 50%, в то время как все три образца белка BSA с жиром (1-3) имели спиральный процент в среднем выше 51% ( Дополнительная таблица 2 ). Более выраженные различия в спиральности наблюдались при 70 ° C, и, отражая данные DLS, результаты также подтверждают, что среди образцов BSA с жиром, белок BSA (1) имел самый низкий процент спиральности и, следовательно, самую низкую термостабильность. Относительно низкая термостабильность белка BSA (1) согласуется с его обработкой только фракционированием холодным этанолом, и, таким образом, связываются только природные жирные кислоты в отсутствие дополнительного стабилизатора жирных кислот (как используется при фракционировании тепловым шоком).В совокупности результаты DLS и CD-спектроскопии демонстрируют, что образцы BSA с жиром обладают большей термостабильностью, чем образцы с обезжиренным BSA, подтверждая, что конформационная свободная энергия образцов BSA с жиром ниже, чем образцов с обезжиренным BSA.
Все три образца обезжиренных белков BSA (4-6) имели спиральный процент в среднем ниже 50%, в то время как все три образца белка BSA с жиром (1-3) имели спиральный процент в среднем выше 51% ( Дополнительная таблица 2 ). Более выраженные различия в спиральности наблюдались при 70 ° C, и, отражая данные DLS, результаты также подтверждают, что среди образцов BSA с жиром, белок BSA (1) имел самый низкий процент спиральности и, следовательно, самую низкую термостабильность. Относительно низкая термостабильность белка BSA (1) согласуется с его обработкой только фракционированием холодным этанолом, и, таким образом, связываются только природные жирные кислоты в отсутствие дополнительного стабилизатора жирных кислот (как используется при фракционировании тепловым шоком).В совокупности результаты DLS и CD-спектроскопии демонстрируют, что образцы BSA с жиром обладают большей термостабильностью, чем образцы с обезжиренным BSA, подтверждая, что конформационная свободная энергия образцов BSA с жиром ниже, чем образцов с обезжиренным BSA.
Адсорбционное поведение жирных и обезжиренных белков BSA
Эти результаты привели нас к исследованию адсорбционных свойств белков BSA на гидрофильных поверхностях диоксида кремния ( Рис. 3a) . Когда белок с более высокой конформационной энергией адсорбируется на твердой поверхности, ожидается, что он подвергнется большему разворачиванию и распространению по поверхности из-за энтропийного прироста, в то время как другие факторы, такие как взаимодействия белок-поверхность и белок-белок, также влияют на результат 41, 42 .Мы провели эксперименты по микровесам-диссипации кристаллов кварца (QCM-D), чтобы отслеживать кинетику адсорбции и соответствующие массовые и вязкоупругие свойства адсорбированных белковых молекул БСА. Метод QCM-D измеряет в реальном времени изменения резонансной частоты (ΔF) и свойств рассеяния энергии (ΔD) поверхности сенсора с кремнеземным покрытием в зависимости от времени, что дает представление о гидродинамически связанной массе и вязкоупругих свойствах сенсора.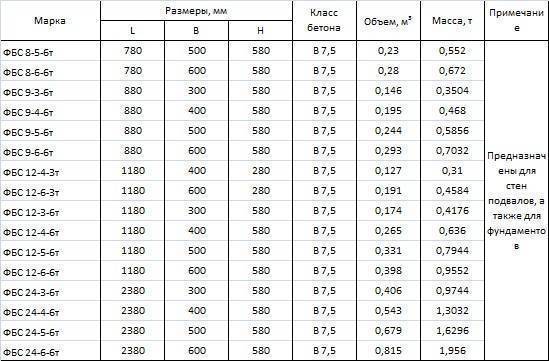 адсорбированный белок БСА | ΔF max | смещают молекулы на поверхности кремнезема соответственно.Большее значение указывает на большую адсорбцию белка, а большее значение | ΔF / ΔD | сдвиг отражает большую жесткость (меньшую вязкоупругость) внутри адсорбированного белкового слоя.
адсорбированный белок БСА | ΔF max | смещают молекулы на поверхности кремнезема соответственно.Большее значение указывает на большую адсорбцию белка, а большее значение | ΔF / ΔD | сдвиг отражает большую жесткость (меньшую вязкоупругость) внутри адсорбированного белкового слоя.
a , Обзор экспериментального протокола тестирования реагентов BSA. (i) Базовый сигнал устанавливается в водном буферном растворе (ii) добавляется 100 мкМ BSA в эквивалентном буферном растворе (начало при t = 5 мин). (iii) Адсорбция БСА продолжается до достижения насыщения.(iv) Выполняется стадия промывки буфера (начата при t = 35 мин и обозначена стрелкой на панелях b, d, f ), и (v) формируется слой адсорбированного белка BSA. b-e , QCM-D эксперименты были проведены для измерения частоты (ΔF) и диссипации энергии (ΔD) сигналов, связанных с процессом адсорбции белка. b , QCM-D ΔF сдвигов с временным разрешением и c , соответствующий | ΔF max | смещается при насыщении. d , QCM-D ΔD сдвиги с временным разрешением. e , | ΔF макс / ΔD макс | отношения, полученные из данных о насыщении на панелях b, и d. f-g , эксперименты LSPR были проведены для измерения сигналов Δλ max , связанных с процессом адсорбции белка. f , временные сдвиги длины волны LSPR (Δλ) и g , соответствующие Δλ max сдвигов при насыщении. Данные в c, e, g представлены как среднее ± стандартное отклонение. ( n = 3 биологических повтора, однофакторный дисперсионный анализ с тестом множественных сравнений Тьюки). Значения P приведены для обезжиренных белков БСА (по сравнению с жирными белками БСА из того же метода фракционирования). Точки представляют отдельные точки данных.
b , QCM-D ΔF сдвигов с временным разрешением и c , соответствующий | ΔF max | смещается при насыщении. d , QCM-D ΔD сдвиги с временным разрешением. e , | ΔF макс / ΔD макс | отношения, полученные из данных о насыщении на панелях b, и d. f-g , эксперименты LSPR были проведены для измерения сигналов Δλ max , связанных с процессом адсорбции белка. f , временные сдвиги длины волны LSPR (Δλ) и g , соответствующие Δλ max сдвигов при насыщении. Данные в c, e, g представлены как среднее ± стандартное отклонение. ( n = 3 биологических повтора, однофакторный дисперсионный анализ с тестом множественных сравнений Тьюки). Значения P приведены для обезжиренных белков БСА (по сравнению с жирными белками БСА из того же метода фракционирования). Точки представляют отдельные точки данных.
Все шесть белков BSA, адсорбированных на поверхности диоксида кремния, и частотные сигналы QCM-D указывают на монотонную кинетику адсорбции ( Рис. 3b ). Наибольшее количество адсорбированных белковых молекул составляло | ΔF max | связывается необратимо, судя по стадии промывки буфера. В целом, для обезжиренных белков БСА наблюдались большие сдвиги примерно от 35 до 45 Гц (4-6), что указывает на большую адсорбцию ( рис.3c ). Напротив, была меньшая адсорбция жирных белков BSA (1-3), на что указывает | ΔF max | сдвигается от 15 до 35 Гц. Соответствующие сигналы диссипации энергии QCM-D также указывали на монотонную адсорбцию белка и некоторую степень вязкоупругого характера внутри адсорбированного белкового слоя ( рис. 3d, ). Аппроксимация вязкоупругой модели показала, что адсорбирующие белковые слои имеют эффективную толщину порядка 3-6 нм, что соответствует одному слою адсорбированных белковых молекул ( дополнительный рис. 5 ). После стадии промывки буфером оставшиеся связанные белковые молекулы имели более жесткое расположение. Дальнейший анализ | ΔF max / ΔD max | соотношение показало, что адсорбированные белковые слои из обезжиренных белков БСА (4-6) были более плотно связаны с поверхностью диоксида кремния, что согласуется с более низкой конформационной стабильностью (в растворе) и большей денатурацией, индуцированной поверхностью ( Рис. 3e и Дополнительные Рис.6 ). С другой стороны, жирные белки BSA (1-3) проявляли более вязкоупругий характер, что свидетельствует о меньшей денатурации, индуцированной поверхностью.
5 ). После стадии промывки буфером оставшиеся связанные белковые молекулы имели более жесткое расположение. Дальнейший анализ | ΔF max / ΔD max | соотношение показало, что адсорбированные белковые слои из обезжиренных белков БСА (4-6) были более плотно связаны с поверхностью диоксида кремния, что согласуется с более низкой конформационной стабильностью (в растворе) и большей денатурацией, индуцированной поверхностью ( Рис. 3e и Дополнительные Рис.6 ). С другой стороны, жирные белки BSA (1-3) проявляли более вязкоупругий характер, что свидетельствует о меньшей денатурации, индуцированной поверхностью.
Чтобы подтвердить результаты QCM-D, мы также провели эксперименты с локализованным поверхностным плазмонным резонансом (LSPR) для измерения адсорбции белка BSA на поверхностях, покрытых диоксидом кремния. В то время как метод QCM-D чувствителен к массе адсорбированного белка и массе гидродинамически связанного растворителя, метод LSPR обнаруживает сдвиг длины волны (Δλ), который связан с изменениями локального показателя преломления вблизи поверхности сенсора, и сигнал измерения чувствителен только к масса адсорбированного белка (не связанный растворитель) 38 . В экспериментах LSPR смещение Δλ отслеживается как функция времени, при этом больший сдвиг Δλ указывает на большую адсорбцию белка. Для всех шести белков БСА произошел положительный сдвиг Δλ и наблюдалась монотонная кинетика адсорбции ( рис. 3f, ). После стадии промывки буфером большинство белковых молекул оставалось связанным. Важно отметить, что сдвиги Δλ max показали, что обезжиренные белки БСА проявляли большее адсорбционное поглощение, чем жирные белки БСА (∼1,2 ± 0,2 нм против ∼0,6 ± 0.2 нм), что хорошо согласуется с данными QCM-D ( Рис. 3g ). Таким образом, обезжиренные белки БСА проявляли более высокое поглощение адсорбцией и более плотную упаковку адсорбционного слоя, тогда как жирные белки БСА имели более низкое поглощение адсорбцией и более слабую упаковку адсорбционного слоя.
В экспериментах LSPR смещение Δλ отслеживается как функция времени, при этом больший сдвиг Δλ указывает на большую адсорбцию белка. Для всех шести белков БСА произошел положительный сдвиг Δλ и наблюдалась монотонная кинетика адсорбции ( рис. 3f, ). После стадии промывки буфером большинство белковых молекул оставалось связанным. Важно отметить, что сдвиги Δλ max показали, что обезжиренные белки БСА проявляли большее адсорбционное поглощение, чем жирные белки БСА (∼1,2 ± 0,2 нм против ∼0,6 ± 0.2 нм), что хорошо согласуется с данными QCM-D ( Рис. 3g ). Таким образом, обезжиренные белки БСА проявляли более высокое поглощение адсорбцией и более плотную упаковку адсорбционного слоя, тогда как жирные белки БСА имели более низкое поглощение адсорбцией и более слабую упаковку адсорбционного слоя.
Связанные с адсорбцией конформационные изменения белка
Для дальнейшего сравнения степени индуцированной поверхностью денатурации белка для каждого белка BSA мы проанализировали данные измерения LSPR, вычислив начальную скорость поглощения адсорбцией, которая обозначается как (dΔλ / dt) max ( дополнительный рис. 7 ). Метод LSPR представляет собой подход к измерениям с высокой чувствительностью к поверхности, и можно связать начальную скорость адсорбции с относительной степенью поверхностной денатурации белка, при этом более высокая начальная скорость указывает на большую денатурацию 40, 43 . Следовательно, данные LSPR показали, что обезжиренные белки БСА претерпевают более обширную поверхностно-индуцированную денатурацию, на что указывают начальные скорости адсорбции около 0,6-0,7 нм мин -1 ( Рис. 4a ).С другой стороны, начальные скорости адсорбции жирных белков BSA составляли всего около 0,2-0,3 нм · мин -1 , что указывает на меньшую денатурацию, индуцированную поверхностью.
7 ). Метод LSPR представляет собой подход к измерениям с высокой чувствительностью к поверхности, и можно связать начальную скорость адсорбции с относительной степенью поверхностной денатурации белка, при этом более высокая начальная скорость указывает на большую денатурацию 40, 43 . Следовательно, данные LSPR показали, что обезжиренные белки БСА претерпевают более обширную поверхностно-индуцированную денатурацию, на что указывают начальные скорости адсорбции около 0,6-0,7 нм мин -1 ( Рис. 4a ).С другой стороны, начальные скорости адсорбции жирных белков BSA составляли всего около 0,2-0,3 нм · мин -1 , что указывает на меньшую денатурацию, индуцированную поверхностью.
a , Максимальная скорость изменения сдвига длины волны LSPR (dΔλ / dt) max во время начальной стадии адсорбции. Значения рассчитываются по данным на рис. 3f. Данные представлены как среднее ± стандартное отклонение. ( n = 3 биологических повтора, однофакторный дисперсионный анализ с тестом множественных сравнений Тьюки). b , Долевой процент α-спиральности в молекулах белка BSA в растворе и в адсорбированном состоянии, как определено в экспериментах по спектроскопии ATR-FTIR. Данные представлены как среднее ± стандартное отклонение. ( n = 3 биологических повтора, двухфакторный дисперсионный анализ с тестом множественных сравнений Тьюки). Значения P приводятся для обезжиренных белков BSA (по сравнению с жирными белками BSA из того же метода фракционирования) в a и отдельно для обезжиренных белков BSA в растворе (по сравнению с жирными белками BSA в растворе из того же метода фракционирования) и для обезжиренных белков БСА в адсорбированном состоянии (по сравнению с жирными белками БСА в адсорбированном состоянии из того же метода фракционирования) в b .Точки представляют отдельные точки данных.
3f. Данные представлены как среднее ± стандартное отклонение. ( n = 3 биологических повтора, однофакторный дисперсионный анализ с тестом множественных сравнений Тьюки). b , Долевой процент α-спиральности в молекулах белка BSA в растворе и в адсорбированном состоянии, как определено в экспериментах по спектроскопии ATR-FTIR. Данные представлены как среднее ± стандартное отклонение. ( n = 3 биологических повтора, двухфакторный дисперсионный анализ с тестом множественных сравнений Тьюки). Значения P приводятся для обезжиренных белков BSA (по сравнению с жирными белками BSA из того же метода фракционирования) в a и отдельно для обезжиренных белков BSA в растворе (по сравнению с жирными белками BSA в растворе из того же метода фракционирования) и для обезжиренных белков БСА в адсорбированном состоянии (по сравнению с жирными белками БСА в адсорбированном состоянии из того же метода фракционирования) в b .Точки представляют отдельные точки данных.
Кроме того, были выполнены измерения инфракрасной спектроскопии с ослабленным полным отражением с преобразованием Фурье (ATR-FTIR) для измерения изменения в структуре белка BSA из-за связанных с адсорбцией конформационных изменений. Как правило, в фазе раствора жирные молекулы БСА имели α-спиральность около 63%, в то время как обезжиренные молекулы имели α-спиральность около 60%, что согласуется с литературными значениями 44, 45 ( Рис. 4b, Дополнительный Рис. 8 и Дополнительная таблица 3 ).После адсорбции жирные молекулы БСА претерпели денатурацию, вызванную поверхностью, и относительная спиральность уменьшилась примерно до 53%, что указывает на чистую спиральную потерю ~ 10%. Напротив, при адсорбции обезжиренные молекулы BSA претерпевают большую денатурацию, вызванную поверхностью, и результирующая фракционная спиральность составляет около 45%, что соответствует чистым спиральным потерям ~ 15%. Таким образом, несколько линий экспериментальных данных подтверждают, что обезжиренные молекулы БСА демонстрируют большую поверхностную денатурацию, чем жирные молекулы БСА. Это открытие согласуется с более низкой конформационной стабильностью, демонстрируемой обезжиренными молекулами BSA в растворе, и подтверждает, что пониженная конформационная стабильность белка в фазе раствора трансформируется в более выраженную денатурацию в адсорбированном состоянии.
Это открытие согласуется с более низкой конформационной стабильностью, демонстрируемой обезжиренными молекулами BSA в растворе, и подтверждает, что пониженная конформационная стабильность белка в фазе раствора трансформируется в более выраженную денатурацию в адсорбированном состоянии.
Характеристики нанесения поверхностного покрытия
Поскольку многочисленные применения белковых молекул BSA связаны с их ролью в качестве поверхностных покрытий, мы затем исследовали характеристики нанесения шести образцов BSA в биотестах на основе поверхности и наночастиц.Сначала мы измерили блокирующую эффективность покрытий из адсорбированного БСА для подавления биообрастания сыворотки на поверхностях диоксида кремния ( Рис. 5a, и Дополнительный Рис. 9, ). Голую поверхность диоксида кремния сначала покрывали молекулами белка BSA перед инкубацией поверхности, покрытой BSA, в 100% фетальной бычьей сыворотке (FBS) в течение 30 минут с последующей стадией промывки. Полученное количество биообрастания сыворотки на поверхности диоксида кремния, покрытой BSA, оценивали с помощью метода QCM-D. Эффективность блокирования BSA-покрытия рассчитывалась на основе степени подавления биообрастания сыворотки.Было определено, что обезжиренные белки BSA превосходят жирные белки BSA, а обезжиренные белки BSA (5) и (6) имеют эффективность блокирования около 90% ( Рис. 5b ). С другой стороны, жирные белки BSA (1) и (3) продемонстрировали эффективность блокирования менее 40%. Эти результаты согласуются с более высоким поглощением адсорбцией и более высокой плотностью упаковки адсорбированных обезжиренных белковых молекул БСА. Аналогичные результаты были получены при тестировании жирных и обезжиренных белков БСА в экспериментах вестерн-блоттинга с участием поверхности нитроцеллюлозной мембраны ( дополнительных фиг.10-12 и (Дополнительное примечание 1 ).
Полученное количество биообрастания сыворотки на поверхности диоксида кремния, покрытой BSA, оценивали с помощью метода QCM-D. Эффективность блокирования BSA-покрытия рассчитывалась на основе степени подавления биообрастания сыворотки.Было определено, что обезжиренные белки BSA превосходят жирные белки BSA, а обезжиренные белки BSA (5) и (6) имеют эффективность блокирования около 90% ( Рис. 5b ). С другой стороны, жирные белки BSA (1) и (3) продемонстрировали эффективность блокирования менее 40%. Эти результаты согласуются с более высоким поглощением адсорбцией и более высокой плотностью упаковки адсорбированных обезжиренных белковых молекул БСА. Аналогичные результаты были получены при тестировании жирных и обезжиренных белков БСА в экспериментах вестерн-блоттинга с участием поверхности нитроцеллюлозной мембраны ( дополнительных фиг.10-12 и (Дополнительное примечание 1 ).

a , Схематическое изображение анализа биообрастания сыворотки на поверхности диоксида кремния. Поверхности из диоксида кремния, покрытые чистым и BSA, инкубировали в 100% -ной фетальной бычьей сыворотке (FBS) с последующей стадией промывки буфером, и количество биообрастания сыворотки на поверхностях определяли с помощью измерений QCM-D. Эффективность блокирования BSA-покрытий рассчитывалась относительно поверхности без покрытия. b , Эффективность блокирования покрытий BSA для подавления биообрастания сыворотки на поверхностях диоксида кремния ( n = 3 биологических повтора). c , схематическая иллюстрация активируемого наночастицами анализа активации комплемента. Наночастицы диоксида кремния, покрытые чистым и BSA, инкубировали в 100% нормальной сыворотке человека (NHS) с последующими измерениями ELISA для определения степени активации комплемента, запускаемой наночастицами, на что указывает величина продукции sC5b-9. Эффективность защиты покрытий BSA рассчитывалась относительно наночастиц без покрытия. d , Эффективность защиты покрытий BSA для ингибирования индуцированной наночастицами активации комплемента ( n = 5 биологических повторов). Данные в b и d представлены как среднее ± стандартное отклонение. (односторонний дисперсионный анализ с тестом множественных сравнений Тьюки). Значения P приведены для обезжиренных белков БСА (по сравнению с жирными белками БСА из того же метода фракционирования). Точки представляют отдельные точки данных.
d , Эффективность защиты покрытий BSA для ингибирования индуцированной наночастицами активации комплемента ( n = 5 биологических повторов). Данные в b и d представлены как среднее ± стандартное отклонение. (односторонний дисперсионный анализ с тестом множественных сравнений Тьюки). Значения P приведены для обезжиренных белков БСА (по сравнению с жирными белками БСА из того же метода фракционирования). Точки представляют отдельные точки данных.
Мы также протестировали блокирующую способность покрытий BSA на наночастицах диоксида кремния для ингибирования индуцированной наночастицами активации комплемента, которая является острым иммунным ответом, который может возникать в сыворотке крови человека ( Рис.5c ) 46-49 . Используя твердофазный иммуноферментный анализ (ELISA), мы измерили степень защиты, которую покрытия BSA обеспечивали против активации комплемента, индуцированной наночастицами, о чем судили по количеству биомаркера белка SC5b-9 в растворе ( Рис. 5d и Дополнительные Рис.13 ). Более высокие концентрации белка SC5b-9 указывают на более обширную активацию комплемента, и, наоборот, наночастицы с более защитным покрытием будут вызывать более низкие уровни концентрации белка SC5b-9 по сравнению с голыми наночастицами.Экспериментально было определено, что обезжиренные покрытия из БСА ингибируют более 60% образования SC5b-9, тогда как покрытия из жирного БСА проявляют 40% или менее эффективность защиты. Это открытие подтверждает, что обезжиренные покрытия из БСА превосходят покрытия из жирного БСА в плане защиты от активации комплемента, вызванной наночастицами. Таким образом, в анализах на основе поверхности и наночастиц обезжиренные белки БСА показали лучшие функциональные характеристики, чем жирные белки БСА.
5d и Дополнительные Рис.13 ). Более высокие концентрации белка SC5b-9 указывают на более обширную активацию комплемента, и, наоборот, наночастицы с более защитным покрытием будут вызывать более низкие уровни концентрации белка SC5b-9 по сравнению с голыми наночастицами.Экспериментально было определено, что обезжиренные покрытия из БСА ингибируют более 60% образования SC5b-9, тогда как покрытия из жирного БСА проявляют 40% или менее эффективность защиты. Это открытие подтверждает, что обезжиренные покрытия из БСА превосходят покрытия из жирного БСА в плане защиты от активации комплемента, вызванной наночастицами. Таким образом, в анализах на основе поверхности и наночастиц обезжиренные белки БСА показали лучшие функциональные характеристики, чем жирные белки БСА.
Обсуждение
Наши экспериментальные данные демонстрируют, что обезжиренные белки БСА проявляют отличные конформационные и адсорбционные свойства от жирных белков БСА, и эти различия приводят к значительным вариациям в блокирующей способности. В целом, данные указывают на центральную роль молекул жирных кислот в влиянии на структуру и функцию BSA. Чтобы проверить эффект жирных кислот, мы также добавили в обезжиренный БСА каприловую кислоту, тем самым превратив обезжиренный белок в жирный белок. Добавление каприловой кислоты привело к заметно повышенной конформационной стабильности наряду со снижением адсорбционного поглощения и денатурации и, как следствие, более плохой блокирующей способностью ( дополнительные рисунки 14-23, дополнительные таблицы 4-5 и дополнительные примечания 2 ).С механической точки зрения повышенная конформационная стабильность белков BSA с жиром может быть понята посредством встраивания молекул каприловой кислоты (через гидрофобные хвосты) в гидрофобные карманы на молекулярной поверхности белков BSA, что оказывает общий стабилизирующий эффект на структуру белка 50, 51 .
В целом, данные указывают на центральную роль молекул жирных кислот в влиянии на структуру и функцию BSA. Чтобы проверить эффект жирных кислот, мы также добавили в обезжиренный БСА каприловую кислоту, тем самым превратив обезжиренный белок в жирный белок. Добавление каприловой кислоты привело к заметно повышенной конформационной стабильности наряду со снижением адсорбционного поглощения и денатурации и, как следствие, более плохой блокирующей способностью ( дополнительные рисунки 14-23, дополнительные таблицы 4-5 и дополнительные примечания 2 ).С механической точки зрения повышенная конформационная стабильность белков BSA с жиром может быть понята посредством встраивания молекул каприловой кислоты (через гидрофобные хвосты) в гидрофобные карманы на молекулярной поверхности белков BSA, что оказывает общий стабилизирующий эффект на структуру белка 50, 51 .
Менее очевидное, но критически важное влияние каприловой кислоты на структуру BSA относится к самому процессу адсорбции белка ( Рис. 6 ). Когда белок адсорбируется на поверхности, белок обычно претерпевает индуцированную поверхностью денатурацию, и степень денатурации белка зависит от комбинации факторов, включая внутреннюю конформационную стабильность белка и величину взаимодействий белок-поверхность 42 .Большая денатурация вызывает большее распространение белка по поверхности, что означает, что площадь контактной поверхности на одну адсорбирующую молекулу белка больше. Таким образом, обычно понимается, что большее распространение отдельных белковых молекул приводит к меньшему общему количеству адсорбированных белковых молекул на целевой поверхности, независимо от того, вызвано ли большее распространение конформационной стабильностью (см. , например, , ссылка 52 ) или взаимодействия белок-поверхность (см. , например, , Ref.53). С этой точки зрения можно рационализировать, как изменение ионной силы влияет на адсорбцию и распространение белка BSA для одного типа BSA 25 .
6 ). Когда белок адсорбируется на поверхности, белок обычно претерпевает индуцированную поверхностью денатурацию, и степень денатурации белка зависит от комбинации факторов, включая внутреннюю конформационную стабильность белка и величину взаимодействий белок-поверхность 42 .Большая денатурация вызывает большее распространение белка по поверхности, что означает, что площадь контактной поверхности на одну адсорбирующую молекулу белка больше. Таким образом, обычно понимается, что большее распространение отдельных белковых молекул приводит к меньшему общему количеству адсорбированных белковых молекул на целевой поверхности, независимо от того, вызвано ли большее распространение конформационной стабильностью (см. , например, , ссылка 52 ) или взаимодействия белок-поверхность (см. , например, , Ref.53). С этой точки зрения можно рационализировать, как изменение ионной силы влияет на адсорбцию и распространение белка BSA для одного типа BSA 25 .
a , Схематическое изображение жирных и обезжиренных белковых молекул BSA в растворе. Наличие жирных кислот приводит к более высокой конформационной стабильности в растворе. b , схематическое изображение жирных и обезжиренных белковых молекул БСА в адсорбированном состоянии.Более высокая конформационная стабильность жирного БСА приводит к меньшей денатурации, вызванной адсорбцией, большему отталкиванию белков и, следовательно, менее плотно упакованным белковым покрытиям. С другой стороны, более низкая конформационная стабильность обезжиренного БСА приводит к большей денатурации, вызванной адсорбцией, меньшему отталкиванию белок-белок и, следовательно, более плотно упакованным белковым покрытиям. В результате обезжиренные белки BSA образуют более эффективные пассивирующие покрытия поверхности, которые более полезны для блокирующих применений.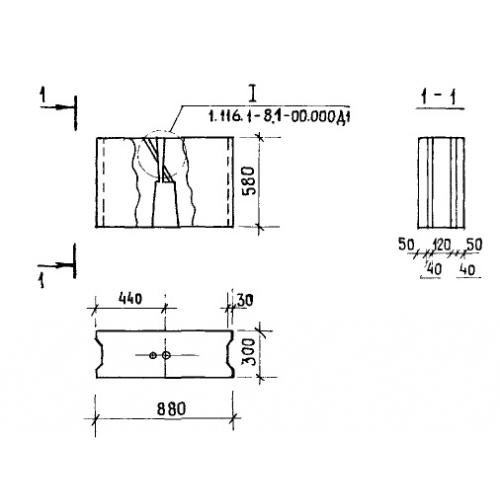
Однако ситуация становится более сложной при сравнении обезжиренных и жирных белков БСА, поскольку молекулы каприловой кислоты не только повышают конформационную стабильность, но и выступающие головные группы карбоновых кислот молекул каприловой кислоты также увеличивают характер отрицательного поверхностного заряда молекул белка БСА.Жирные белки БСА обладают большей конформационной стабильностью и, следовательно, в адсорбированном состоянии претерпевают меньшую поверхностную денатурацию. Тем не менее, хотя жирные белки БСА имеют меньшую площадь контактной поверхности на молекулу, максимальная поверхностная плотность адсорбированных белковых молекул в этом случае ограничена отталкивающими электростатическими взаимодействиями между ближайшими соседними белковыми молекулами.
С другой стороны, обезжиренные белки БСА имеют более низкую конформационную стабильность и в большей степени денатурируют в адсорбированном состоянии.Следовательно, обезжиренные белки БСА подвергаются большему растеканию и имеют большую площадь поверхности контакта на адсорбированную молекулу. Однако максимальная поверхностная плотность адсорбированных белков в случае с обезжиренным BSA все еще выше, чем в случае с BSA с жиром, потому что между адсорбированными обезжиренными молекулами BSA меньше отталкивающих белок-белковых взаимодействий. Следовательно, обезжиренные белки БСА полезны для образования пассивирующих покрытий по двум основным причинам. Во-первых, они обладают более низкой конформационной стабильностью, что способствует большей денатурации и растеканию в адсорбированном состоянии.Во-вторых, отсутствие молекул жирных кислот в обезжиренных белках БСА обеспечивает более благоприятные белок-белковые взаимодействия, которые поддерживают образование плотно упакованных адсорбированных белковых слоев на целевых поверхностях.
Однако максимальная поверхностная плотность адсорбированных белков в случае с обезжиренным BSA все еще выше, чем в случае с BSA с жиром, потому что между адсорбированными обезжиренными молекулами BSA меньше отталкивающих белок-белковых взаимодействий. Следовательно, обезжиренные белки БСА полезны для образования пассивирующих покрытий по двум основным причинам. Во-первых, они обладают более низкой конформационной стабильностью, что способствует большей денатурации и растеканию в адсорбированном состоянии.Во-вторых, отсутствие молекул жирных кислот в обезжиренных белках БСА обеспечивает более благоприятные белок-белковые взаимодействия, которые поддерживают образование плотно упакованных адсорбированных белковых слоев на целевых поверхностях.
В совокупности наши результаты подтверждают, что предпочтительнее использовать белковые реагенты BSA, не содержащие жирных кислот, для блокирования приложений в биоанализах на основе поверхности и наночастиц. В целом, белки BSA, не содержащие жирных кислот, превосходят по эффективности белки BSA, стабилизированные жирными кислотами, в значительной степени независимо от способа фракционирования, который использовался на стадии очистки. Механически мы показываем, что обезжиренные белки БСА являются лучшими блокирующими реагентами, поскольку они имеют более низкую конформационную стабильность в растворе, что приводит к большей адсорбции и поверхностной денатурации, а также к более плотной упаковке адсорбента, что в совокупности приводит к превосходным пассивирующим покрытиям. В зависимости от специфики анализа может потребоваться дополнительное рассмотрение уровня чистоты BSA (, т.е. , остаточные уровни одного или нескольких конкретных компонентов плазмы), в то время как статус отсутствия жирных кислот является основным критерием выбора для обеспечения оптимальных блокирующих свойств.Заглядывая в будущее, наш аналитический подход выделяет ряд важных функциональных свойств — конформационную стабильность в фазе раствора, поглощение адсорбцией, поверхностную денатурацию и молекулярную упаковку в белковой оболочке, — которые важно учитывать при оценке реагентов на основе белка для блокирующие приложения, а также может направлять разработку улучшенных версий BSA и других блокирующих реагентов на основе белков как отдельно, так и в составе многокомпонентных буферных растворов.
Механически мы показываем, что обезжиренные белки БСА являются лучшими блокирующими реагентами, поскольку они имеют более низкую конформационную стабильность в растворе, что приводит к большей адсорбции и поверхностной денатурации, а также к более плотной упаковке адсорбента, что в совокупности приводит к превосходным пассивирующим покрытиям. В зависимости от специфики анализа может потребоваться дополнительное рассмотрение уровня чистоты BSA (, т.е. , остаточные уровни одного или нескольких конкретных компонентов плазмы), в то время как статус отсутствия жирных кислот является основным критерием выбора для обеспечения оптимальных блокирующих свойств.Заглядывая в будущее, наш аналитический подход выделяет ряд важных функциональных свойств — конформационную стабильность в фазе раствора, поглощение адсорбцией, поверхностную денатурацию и молекулярную упаковку в белковой оболочке, — которые важно учитывать при оценке реагентов на основе белка для блокирующие приложения, а также может направлять разработку улучшенных версий BSA и других блокирующих реагентов на основе белков как отдельно, так и в составе многокомпонентных буферных растворов.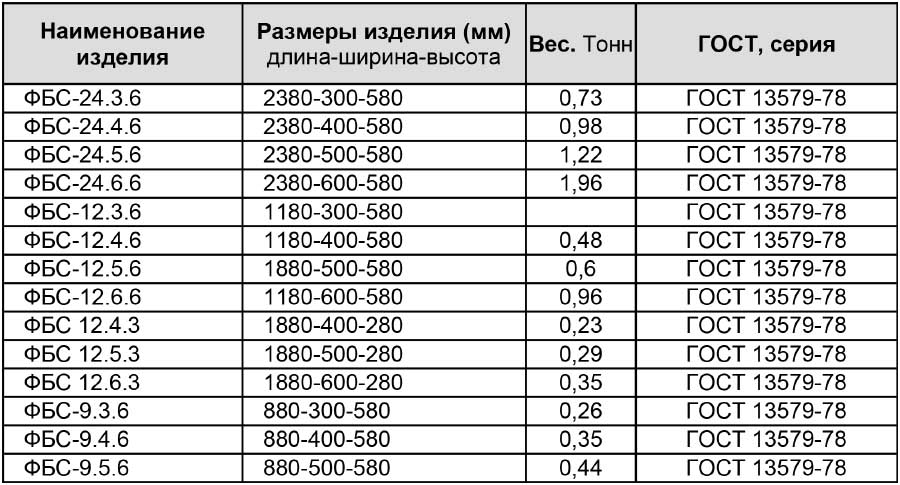
Вклад авторов
G.J.M, A.R.F, J.A.J. и N.-J.C. запланировал исследования. G.J.M. и A.R.F. проводил эксперименты. G.J.M., A.R.F., J.A.J. и N.-J.C. интерпретировал результаты. J.A.J. и N.-J.C. получено финансирование. G.J.M., A.R.F. и J.A.J. написал первый черновик рукописи. Все авторы просмотрели, отредактировали и одобрили статью.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Методы
Белки бычьего сывороточного альбумина
Шесть типов бычьего сывороточного альбумина (БСА), использованные в этом исследовании, были выбраны на основе трех различных методов фракционирования без или с этапом удаления жирных кислот, и были закуплены у Sigma-Aldrich ( Санкт-ПетербургЛуис, Миссури, США). Лиофилизированные порошки белков БСА, содержащих жирные кислоты, очищенные фракционированием холодным этанолом, фракционированием тепловым шоком или холодным этанолом с последующим фракционированием тепловым шоком, были отобраны и имеют каталожные номера. A2153, A3059 и A7638 соответственно. Эти три жирных белка BSA были обозначены как BSA 1, 2, 3 соответственно. Были также получены соответствующие версии без жирных кислот, имеющие каталожные номера. A6003, A7030 и A0281 соответственно. Эти три обезжиренных белка BSA были обозначены как BSA 4, 5, 6 соответственно.
A2153, A3059 и A7638 соответственно. Эти три жирных белка BSA были обозначены как BSA 1, 2, 3 соответственно. Были также получены соответствующие версии без жирных кислот, имеющие каталожные номера. A6003, A7030 и A0281 соответственно. Эти три обезжиренных белка BSA были обозначены как BSA 4, 5, 6 соответственно.
Реагенты
Додецилсульфат натрия (SDS, каталожный номер L4390), хлорид натрия (NaCl, каталожный номер 746398), гидроксид натрия (каталожный номер S5881) и октановая кислота (каприловая кислота, каталожный номер C2875) также были приобретен у Sigma-Aldrich, в то время как трис (гидроксиметил) аминометан (Трис, каталожный № 0497) был приобретен у Amresco (Солон, Огайо, США). Этанол (95%) был приобретен у Aik Moh (Сингапур), соляная кислота (HCl, каталожный номер 100317) была куплена у Merck (Берлингтон, Массачусетс, США), а фетальная бычья сыворотка (FBS, каталожный номер.СВ30160.03, лот № RC35960) был приобретен в HyClone Laboratories (Логан, Юта, США) и хранился при -20 ° C до эксперимента.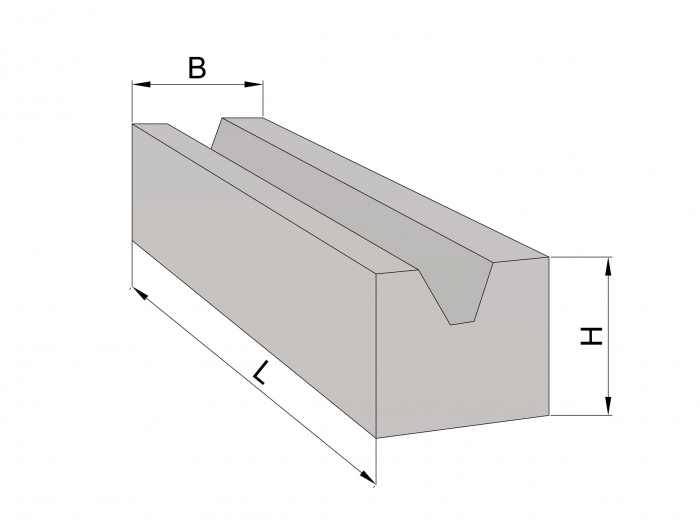 Нормальную человеческую сыворотку (каталожный номер NHS, лот № 38) получали от Complement Technology (Тайлер, Техас, США) и хранили при -80 ° C до эксперимента. 30% раствор акриламида / бис 29: 1 (номер по каталогу 1610156), персульфат аммония (номер по каталогу 1610700), тетраметилэтилендиамин (TEMED, номер по каталогу 1610800), 4-кратный буфер для образцов Лэммли (номер по каталогу 1610747), 2-меркаптоэтанол (каталожный №1610710), 10 × Трис-буферный солевой раствор (TBS, номер по каталогу 1706435), 10 × Трис / глициновый буфер (№ по каталогу 1610734), 10 × буфер Трис / глицин / SDS (№ по каталогу 1610732), Твин 20 (№ по каталогу 1706531), нитроцеллюлозные мембраны (каталожный номер 1620112), стандарты Precision Plus Protein Standards (каталожный номер 1610375), усиленный хемилюминесцентный (ECL) субстрат Clarity Max Western (каталожный номер 1705062) и козьи антитела, конъюгированные с пероксидазой хрена (HRP) -мышиное антитело к иммуноглобулину G (IgG) (каталожный номер 1721011, серия №64109318) были приобретены в Bio-Rad Laboratories (Геркулес, Калифорния, США).
Нормальную человеческую сыворотку (каталожный номер NHS, лот № 38) получали от Complement Technology (Тайлер, Техас, США) и хранили при -80 ° C до эксперимента. 30% раствор акриламида / бис 29: 1 (номер по каталогу 1610156), персульфат аммония (номер по каталогу 1610700), тетраметилэтилендиамин (TEMED, номер по каталогу 1610800), 4-кратный буфер для образцов Лэммли (номер по каталогу 1610747), 2-меркаптоэтанол (каталожный №1610710), 10 × Трис-буферный солевой раствор (TBS, номер по каталогу 1706435), 10 × Трис / глициновый буфер (№ по каталогу 1610734), 10 × буфер Трис / глицин / SDS (№ по каталогу 1610732), Твин 20 (№ по каталогу 1706531), нитроцеллюлозные мембраны (каталожный номер 1620112), стандарты Precision Plus Protein Standards (каталожный номер 1610375), усиленный хемилюминесцентный (ECL) субстрат Clarity Max Western (каталожный номер 1705062) и козьи антитела, конъюгированные с пероксидазой хрена (HRP) -мышиное антитело к иммуноглобулину G (IgG) (каталожный номер 1721011, серия №64109318) были приобретены в Bio-Rad Laboratories (Геркулес, Калифорния, США). Моноклональное антитело комплемента C3b (номер по каталогу MA1-40155, номер партии Sh3428445) было приобретено в Thermo Fisher Scientific (Waltham, MA, USA). Метанол (номер по каталогу M / 4000/17) был получен от Fisher Scientific (Лафборо, Великобритания), а наночастицы диоксида кремния диаметром 100 нм (номер по каталогу SISN100) были получены от компании nanoComposix (Сан-Диего, Калифорния, США).
Моноклональное антитело комплемента C3b (номер по каталогу MA1-40155, номер партии Sh3428445) было приобретено в Thermo Fisher Scientific (Waltham, MA, USA). Метанол (номер по каталогу M / 4000/17) был получен от Fisher Scientific (Лафборо, Великобритания), а наночастицы диоксида кремния диаметром 100 нм (номер по каталогу SISN100) были получены от компании nanoComposix (Сан-Диего, Калифорния, США).
Подготовка образца
Водный буферный раствор 10 мМ Трис, 150 мМ NaCl и pH 7.5 готовили с водой, обработанной Milli-Q (удельное сопротивление> 18,2 МОм · см при 25 ° C), и фильтровали через мембранный фильтр из полиэфирсульфона (PES) 0,2 мкм (Thermo Fisher Scientific, номер по каталогу 595-4520). Растворы БСА получали растворением лиофилизированного порошка БСА в этом Трис-буфере и затем фильтрованием через шприц-фильтр 0,2 мкм (каталожный номер PN-4612; Pall Corporation, Порт Вашингтон, Нью-Йорк, США). Молярные концентрации белков BSA в водном буферном растворе определяли измерениями поглощения ультрафиолетового (УФ) света при 280 нм и со значением коэффициента молярной экстинкции 43 824 M -1 см -1 . Где это применимо, добавление каприловой кислоты к образцам BSA проводили, сначала растворяя каприловую кислоту и гидроксид натрия в Трис-буфере, чтобы получить 50 мМ раствор каприловой кислоты с pH 7,5. Затем раствор каприловой кислоты добавляли к соответствующим количествам раствора BSA, чтобы получить образец BSA с примесью каприловой кислоты с молярным соотношением каприловая кислота: BSA 10: 1. Кроме того, буфер для вестерн-блоттинга готовили путем разбавления 10 × Трис / глицин / SDS-буфер водой до 1 × концентрации, а буфер для переноса получали разбавлением 10 × Трис / глицинового буфера водой и метанолом до 1 × концентрации. и добавление 20% (об. / об.) метанола.Блокирующие растворы, содержащие BSA, для экспериментов вестерн-блоттинга готовили путем первого разбавления 10 × TBS водой с последующим добавлением Tween 20 для получения раствора 1 × TBS с 0,1% (об. / Об.) Tween 20 (TBST). Затем BSA растворяли в TBST с получением 3% (мас. / Об.) Блокирующего раствора BSA.
Где это применимо, добавление каприловой кислоты к образцам BSA проводили, сначала растворяя каприловую кислоту и гидроксид натрия в Трис-буфере, чтобы получить 50 мМ раствор каприловой кислоты с pH 7,5. Затем раствор каприловой кислоты добавляли к соответствующим количествам раствора BSA, чтобы получить образец BSA с примесью каприловой кислоты с молярным соотношением каприловая кислота: BSA 10: 1. Кроме того, буфер для вестерн-блоттинга готовили путем разбавления 10 × Трис / глицин / SDS-буфер водой до 1 × концентрации, а буфер для переноса получали разбавлением 10 × Трис / глицинового буфера водой и метанолом до 1 × концентрации. и добавление 20% (об. / об.) метанола.Блокирующие растворы, содержащие BSA, для экспериментов вестерн-блоттинга готовили путем первого разбавления 10 × TBS водой с последующим добавлением Tween 20 для получения раствора 1 × TBS с 0,1% (об. / Об.) Tween 20 (TBST). Затем BSA растворяли в TBST с получением 3% (мас. / Об.) Блокирующего раствора BSA.
Динамическое рассеяние света
Динамическое рассеяние света (DLS) использовалось для измерения среднего гидродинамического диаметра и полидисперсности молекул белка BSA в растворе с использованием анализатора размера частиц (ZetaPALS, Brookhaven Instruments, Holtsville, NY, USA), который оснащен а 658. Монохроматический лазер 0 нм. Измерения проводились под углом рассеяния 90 °, и программное обеспечение BIC Particle Sizing (v5.27; Brookhaven Instruments) использовалось для анализа функции автокорреляции интенсивности с целью получения гауссова распределения размеров, взвешенного по интенсивности. Температуру в измерительной камере контролировали с помощью петли обратной связи, и измерения образца белка сначала регистрировали при 25 ° C, затем нагревали и повышали температуру с 50 ° C до 75 ° C с шагом 5 ° C.После каждого скачка температуры измерительная камера уравновешивалась в течение 5 мин перед выполнением измерения DLS. В некоторых зависящих от времени измерениях температура в измерительной камере сначала повышалась с 50 ° C до 55 ° C перед поддержанием постоянной температуры на уровне 60 ° C и измерением размера белка каждые 10 мин в течение 200 мин. Все заявленные значения были получены из 5 технических повторений.
Монохроматический лазер 0 нм. Измерения проводились под углом рассеяния 90 °, и программное обеспечение BIC Particle Sizing (v5.27; Brookhaven Instruments) использовалось для анализа функции автокорреляции интенсивности с целью получения гауссова распределения размеров, взвешенного по интенсивности. Температуру в измерительной камере контролировали с помощью петли обратной связи, и измерения образца белка сначала регистрировали при 25 ° C, затем нагревали и повышали температуру с 50 ° C до 75 ° C с шагом 5 ° C.После каждого скачка температуры измерительная камера уравновешивалась в течение 5 мин перед выполнением измерения DLS. В некоторых зависящих от времени измерениях температура в измерительной камере сначала повышалась с 50 ° C до 55 ° C перед поддержанием постоянной температуры на уровне 60 ° C и измерением размера белка каждые 10 мин в течение 200 мин. Все заявленные значения были получены из 5 технических повторений.
Спектроскопия кругового дихроизма
Эксперименты по спектроскопии кругового дихроизма (CD) проводили с использованием спектрометра AVIV Model 420 CD с программным пакетом AVIV CDS (v3. 36 MX) (AVIV Biomedical, Лейквуд, Нью-Джерси, США). Спектроскопические измерения КД проводили с использованием 400 мкл растворов 2,5 мкМ образцов БСА в кювете с длиной оптического пути 1 мм с пробкой из ПТФЭ (каталожный № 110-QS; Hellma, Müllheim, Germany). Измерения регистрировались со спектральной полосой пропускания 1 нм, шагом 0,5 нм и временем усреднения 0,1 с. Эксперименты при повышенных температурах проводились путем увеличения температуры в измерительной камере с шагом 5 ° C от 50 до 75 ° C и регистрации спектров в каждой температурной точке после 5-минутного времени уравновешивания.Все полученные спектры были обработаны путем вычитания фоновых спектров эквивалентных условий раствора без белка BSA, и данные были представлены в единицах средней молярной эллиптичности остатка ([θ]) на основе следующего уравнения: где n — количество аминокислотных остатков, c — молярная концентрация белка, а l — длина пути кюветы в см. Все спектры КД были сглажены с помощью функции сглаживания Savitzky-Golay 54 с окном сглаживания из 20 точек и полиномиальным порядком 2 в OriginPro 2019b (v9.
36 MX) (AVIV Biomedical, Лейквуд, Нью-Джерси, США). Спектроскопические измерения КД проводили с использованием 400 мкл растворов 2,5 мкМ образцов БСА в кювете с длиной оптического пути 1 мм с пробкой из ПТФЭ (каталожный № 110-QS; Hellma, Müllheim, Germany). Измерения регистрировались со спектральной полосой пропускания 1 нм, шагом 0,5 нм и временем усреднения 0,1 с. Эксперименты при повышенных температурах проводились путем увеличения температуры в измерительной камере с шагом 5 ° C от 50 до 75 ° C и регистрации спектров в каждой температурной точке после 5-минутного времени уравновешивания.Все полученные спектры были обработаны путем вычитания фоновых спектров эквивалентных условий раствора без белка BSA, и данные были представлены в единицах средней молярной эллиптичности остатка ([θ]) на основе следующего уравнения: где n — количество аминокислотных остатков, c — молярная концентрация белка, а l — длина пути кюветы в см. Все спектры КД были сглажены с помощью функции сглаживания Savitzky-Golay 54 с окном сглаживания из 20 точек и полиномиальным порядком 2 в OriginPro 2019b (v9. 6.5.169) (OriginLab, Нортгемптон, Массачусетс, США). Процент α-спирали каждого белка BSA был рассчитан из данных [θ] при 222 нм ([θ] 222 ) на основе следующего уравнения 55 :
6.5.169) (OriginLab, Нортгемптон, Массачусетс, США). Процент α-спирали каждого белка BSA был рассчитан из данных [θ] при 222 нм ([θ] 222 ) на основе следующего уравнения 55 :
Мониторинг микровесов-диссипации кристаллов кварца
Измерения микровесов-диссипации кристаллов кварца (QCM-D) проводили с использованием прибора QSense E4 (Biolin Scientific AB, Стокгольм, Швеция). Сенсорный чип из кварцевого кристалла АТ-среза с покрытием из диоксида кремния с основной частотой 5 МГц (QSX 303, Biolin Scientific) использовали для характеристики адсорбции белка на поверхностях из диоксида кремния.Температуру устанавливали на 25 ° C для всех экспериментов, а операцию измерения контролировали с помощью программного пакета QSoft 401 (v2.5.13.664) (Biolin Scientific). Перед каждым экспериментом сенсорные чипы последовательно промывали 1% (масс. / Об.) Водным раствором SDS, водой и этанолом, а затем сушили в слабом потоке газообразного азота с последующей обработкой кислородной плазмой (PDC-002, Harrick Plasma, Итака, Нью-Йорк, США) на 3 мин. Перистальтический насос использовался для закачки жидких образцов в измерительную камеру с объемной скоростью потока 100 мкл мин -1 .Стабильный базовый сигнал был сначала установлен в буферном растворе Трис перед тем, как 100 мкМ белка BSA был введен в измерительную камеру на 30 мин, после чего следовала стадия промывки буфером. Сдвиги резонансной частоты (ΔF) и диссипации энергии (ΔD) регистрировались в реальном времени с несколькими нечетными обертонами, как описано ранее 56 , и приводятся нормализованные данные для пятого обертона. Данные QCM-D также были проанализированы моделью Voigt-Voinova 57 с использованием QTools (v3.0.15.553) (Biolin Scientific), чтобы оценить эффективную толщину слоя адсорбированного белка, образовавшегося после промывки буфера. Для этого анализа предполагалось, что адсорбированный белковый слой представляет собой гомогенный однослойный слой белковых молекул с однородной толщиной и с равномерной эффективной плотностью 1300 кг · м -3 .
Перистальтический насос использовался для закачки жидких образцов в измерительную камеру с объемной скоростью потока 100 мкл мин -1 .Стабильный базовый сигнал был сначала установлен в буферном растворе Трис перед тем, как 100 мкМ белка BSA был введен в измерительную камеру на 30 мин, после чего следовала стадия промывки буфером. Сдвиги резонансной частоты (ΔF) и диссипации энергии (ΔD) регистрировались в реальном времени с несколькими нечетными обертонами, как описано ранее 56 , и приводятся нормализованные данные для пятого обертона. Данные QCM-D также были проанализированы моделью Voigt-Voinova 57 с использованием QTools (v3.0.15.553) (Biolin Scientific), чтобы оценить эффективную толщину слоя адсорбированного белка, образовавшегося после промывки буфера. Для этого анализа предполагалось, что адсорбированный белковый слой представляет собой гомогенный однослойный слой белковых молекул с однородной толщиной и с равномерной эффективной плотностью 1300 кг · м -3 . Плотность и вязкость основного водного буферного раствора были зафиксированы на уровне 1000 кг · м -3 и 0,001 Па · с -1 , соответственно.
Плотность и вязкость основного водного буферного раствора были зафиксированы на уровне 1000 кг · м -3 и 0,001 Па · с -1 , соответственно.
Метод QCM-D также использовался для определения эффективности блокирования BSA-покрытий против биообрастания сыворотки.Для этих экспериментов 100 мкМ раствор BSA сначала добавляли к чистой поверхности диоксида кремния при непрерывном потоке в течение 60 минут, после чего следовала стадия промывки буфером 40 минут. Затем вводили неразбавленную фетальную бычью сыворотку (FBS) при непрерывном потоке в течение 80 минут с последующей стадией заключительной промывки буфером в течение 30 минут. Процент эффективности блокировки был рассчитан путем сравнения абсолютной разницы между сдвигом частоты из-за адсорбции только BSA (после первого этапа промывки буфера) и последующим сдвигом частоты из-за биообрастания FBS (после второго этапа промывки буфером), которая обозначается как ΔF FBS-BSA .Контрольный эксперимент без покрытия BSA также был проведен для измерения абсолютного сдвига частоты из-за одного биообрастания FBS (после стадии промывки буфером), который обозначен как ΔF Control . Для каждого покрытия BSA процент эффективности блокировки рассчитывали по следующему уравнению:
Для каждого покрытия BSA процент эффективности блокировки рассчитывали по следующему уравнению:
Локализованный поверхностный плазмонный резонанс
Усредненный по ансамблю локализованный поверхностный плазмонный резонанс ( LSPR) были проведены в режиме оптического пропускания с использованием прибора Insplorion XNano (Insplorion AB, Гетеборг, Швеция), как описано ранее 58 .Луч белого света, освещающий круглую область размером ∼4 мм 2 , проходит через сенсорный чип с диоксидом кремния (Insplorion), состоящий из хорошо разделенных массивов золотых нанодисков (покрытие поверхности ∼8%), нанесенных методом коллоидной литографии с отверстиями-маской 59 на прозрачной стеклянной подложке. Нанодиски имели среднюю высоту и диаметр 20 и 120 нм. Соответственно, и поверхность сенсорного чипа была конформно покрыта пленкой кремнезема (толщиной ~ 10 нм). Затем свет проходил через окно из кварцевого стекла и собирался спектрофотометром. Перед каждым экспериментом сенсорный чип последовательно промывали 1% (масс. / Об.) Водным раствором SDS, водой и этанолом, затем сушили в слабом потоке газообразного азота. Затем чип обрабатывали кислородной плазмой в течение 2,5 мин. Затем сенсорный чип загружали в измерительную камеру, и жидкие образцы вводили перистальтическим насосом с объемной скоростью потока 100 мкл мин -1 . Стабильный базовый сигнал был установлен в буферном растворе Трис перед тем, как 100 мкМ БСА вводили в измерительную камеру при непрерывном потоке в течение 30 мин, после чего следовала стадия промывки буфером.Программный пакет Insplorer (Insplorion AB) использовался для записи спектров экстинкции LSPR с временным разрешением 1 Гц, а положение центра тяжести (пика) (λ) в спектре экстинкции в каждый момент времени рассчитывалось с использованием полинома высокого порядка. штуцер 60 . Таким образом, можно было определить смещение Δλ с временным разрешением из-за адсорбции белка, а график производной по времени сдвига Δλ также был рассчитан с помощью программного пакета OriginPro 2019b.
Перед каждым экспериментом сенсорный чип последовательно промывали 1% (масс. / Об.) Водным раствором SDS, водой и этанолом, затем сушили в слабом потоке газообразного азота. Затем чип обрабатывали кислородной плазмой в течение 2,5 мин. Затем сенсорный чип загружали в измерительную камеру, и жидкие образцы вводили перистальтическим насосом с объемной скоростью потока 100 мкл мин -1 . Стабильный базовый сигнал был установлен в буферном растворе Трис перед тем, как 100 мкМ БСА вводили в измерительную камеру при непрерывном потоке в течение 30 мин, после чего следовала стадия промывки буфером.Программный пакет Insplorer (Insplorion AB) использовался для записи спектров экстинкции LSPR с временным разрешением 1 Гц, а положение центра тяжести (пика) (λ) в спектре экстинкции в каждый момент времени рассчитывалось с использованием полинома высокого порядка. штуцер 60 . Таким образом, можно было определить смещение Δλ с временным разрешением из-за адсорбции белка, а график производной по времени сдвига Δλ также был рассчитан с помощью программного пакета OriginPro 2019b.
Инфракрасная спектроскопия с ослабленным полным отражением с преобразованием Фурье. Bruker, Баден-Вюртемберг, Германия), который был оснащен аксессуаром MIRacle ATR, содержащим кристалл ZnSe ATR с тремя отражениями (PIKE Technologies, Фитчбург, Висконсин, США).Аликвоту 30 мкл раствора BSA 100 мкМ пипеткой наносили на кристалл ATR для образования капли, и сразу же записывали спектр поглощения, чтобы охарактеризовать вторичную структуру белков BSA в фазе раствора. Затем BSA инкубировали с поверхностью кристалла ATR при комнатной температуре в течение 30 мин, после чего следовала серия из десяти этапов промывки буфером для удаления слабо адсорбированных белков. Во время каждой стадии промывки к капле образца добавляли 30 мкл дополнительного буферного раствора (без белка) с последующей аспирацией из капли общего объема 30 мкл.После завершения этапов промывки регистрировали второй спектр поглощения, чтобы охарактеризовать вторичную структуру белков БСА в адсорбированном состоянии.
 Во время измерений камера для образцов непрерывно продувалась азотом для минимизации влажности окружающей среды. Пакет программного обеспечения OPUS 6.5 (Bruker) использовался для сбора спектров поглощения ATR-FTIR при разрешении 4 см -1 и усреднения по 128 сканированным изображениям. Все записанные спектры были нормализованы путем вычитания фоновых спектров только из буфера и водяного пара, чтобы удалить артефакты поглощения воды и окружающего водяного пара, соответственно.
Во время измерений камера для образцов непрерывно продувалась азотом для минимизации влажности окружающей среды. Пакет программного обеспечения OPUS 6.5 (Bruker) использовался для сбора спектров поглощения ATR-FTIR при разрешении 4 см -1 и усреднения по 128 сканированным изображениям. Все записанные спектры были нормализованы путем вычитания фоновых спектров только из буфера и водяного пара, чтобы удалить артефакты поглощения воды и окружающего водяного пара, соответственно. Относительный вклад различных элементов вторичной структуры был определен для всех образцов путем аппроксимации кривой амидных полос I спектров поглощения (1720-1580 см -1 ) гауссовым компонентам на основе пиков, идентифицированных на графике второй производной спектры поглощения и из литературных ссылок 44, 61-64 . Все анализы аппроксимации кривых проводились с использованием функции Peak Analyzer в программном пакете OriginPro 2019b. Предполагалось, что спектр поглощения, полученный в результате эксперимента, представляет собой линейную комбинацию нескольких составляющих гауссовых пиков, каждый из которых сосредоточен вокруг заданного значения волнового числа и представляет собой элемент вторичной структуры белка. Процентные значения вторичной структуры определяли путем вычисления площади под аппроксимированными кривой пиками, которые были присвоены каждому элементу вторичной структуры, как долю от общей площади под подобранной кривой. Пики с центрами 1682–1678 см –1 были отнесены к структурам β-витков, 1656–1654 см −1 к α-спирали, 1649–1648 см −1 к случайной катушке, 1639–1624 см — 1 для протяженных цепей и 1618-1612 см −1 для межмолекулярных β-листов.
Процентные значения вторичной структуры определяли путем вычисления площади под аппроксимированными кривой пиками, которые были присвоены каждому элементу вторичной структуры, как долю от общей площади под подобранной кривой. Пики с центрами 1682–1678 см –1 были отнесены к структурам β-витков, 1656–1654 см −1 к α-спирали, 1649–1648 см −1 к случайной катушке, 1639–1624 см — 1 для протяженных цепей и 1618-1612 см −1 для межмолекулярных β-листов.
Электрофорез в полиакриламидном геле с додецилсульфатом натрия и вестерн-блоттинг.
Перед экспериментами были приготовлены 10% -ные полиакриламидные гели при pH 8,8 и 5% -ные гели при pH 6,8 с пятнадцатью лунками для загрузки образцов на гель. Для подготовки образцов нормальную человеческую сыворотку (NHS) размораживали, а затем сразу же разбавляли до 1% (об. / Об.) В Трис-буфере с последующей инкубацией при 37 ° C в течение 30 минут. Затем аликвоту разбавленного NHS объемом 180 мкл смешивали с 54 мкл 4-кратного буфера Лэммли и 6 мкл 2-меркаптоэтанола. Затем смесь образцов нагревали до 95 ° C в течение 5 минут для полной денатурации белков сыворотки, а затем снова охлаждали до комнатной температуры. Аликвоту стандартов белка 10 мкл загружали в первую дорожку полиакриламидного геля, а в следующие две дорожки загружали по 10 мкл смеси образцов; эту последовательность повторяли всего пять раз, чтобы заполнить все дорожки в геле. Затем проводили электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) при 50 В в течение 15 минут, а затем при 100 В в течение 90 минут в рабочем буфере.
Затем смесь образцов нагревали до 95 ° C в течение 5 минут для полной денатурации белков сыворотки, а затем снова охлаждали до комнатной температуры. Аликвоту стандартов белка 10 мкл загружали в первую дорожку полиакриламидного геля, а в следующие две дорожки загружали по 10 мкл смеси образцов; эту последовательность повторяли всего пять раз, чтобы заполнить все дорожки в геле. Затем проводили электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) при 50 В в течение 15 минут, а затем при 100 В в течение 90 минут в рабочем буфере.
Полосы белка в геле затем переносили на нитроцеллюлозную мембрану при 300 мА в течение 2 ч в буфере для переноса, и использовали пакеты со льдом, чтобы буфер для переноса оставался холодным во время процесса переноса. После стадии переноса мембраны разрезали на полоски, каждая из которых содержала три дорожки стандартов белка (дорожка 1) и образцы сыворотки (дорожки 2-3). Блокирующие растворы готовили с использованием жирного или обезжиренного BSA [3% (вес / объем) BSA в TBST; BSA 1 или 5], и каждую полоску инкубировали с 5 мл соответствующего блокирующего раствора BSA при комнатной температуре в течение 1 часа. Затем мембраны инкубировали с моноклональным антителом комплемента C3b в качестве первичного антитела (разведение 1: 500 в блокирующем растворе) в течение ночи. Затем каждую мембрану промывали TBST в течение 10 мин. После трех стадий промывки мембраны инкубировали с HRP-конъюгированными вторичными антителами козы против IgG мыши (разведение 1: 2000 в блокирующем растворе) в течение 1 ч с последующими четырьмя последовательными стадиями промывки TBST.
Затем мембраны инкубировали с моноклональным антителом комплемента C3b в качестве первичного антитела (разведение 1: 500 в блокирующем растворе) в течение ночи. Затем каждую мембрану промывали TBST в течение 10 мин. После трех стадий промывки мембраны инкубировали с HRP-конъюгированными вторичными антителами козы против IgG мыши (разведение 1: 2000 в блокирующем растворе) в течение 1 ч с последующими четырьмя последовательными стадиями промывки TBST.
Затем мембраны инкубировали с субстратом Clarity Max Western ECL в течение 5 минут для усиления хемилюминесцентных свойств.Все этапы инкубации и промывки проводились на качающейся платформе. Полосы белка впоследствии были визуализированы с использованием прибора Amersham Imager 600 и сопутствующего программного обеспечения (v0.9.8) (GE Healthcare, Чикаго, Иллинойс, США) с временем экспозиции 1 с. Затем был использован программный пакет Fiji / ImageJ 65 для количественной оценки интенсивности шумовых полос, расположенных около маркеров молекулярной массы 250, 75 и 50 кДа. Цифровое изображение блотов сначала было настроено на 8-битную шкалу серого, а затем был построен профиль интенсивности для каждой выбранной дорожки с использованием функции анализа гелей.Пики из неспецифических интересующих полос были идентифицированы, и базовая линия была создана, проведя прямую линию между двумя точками минимума по обе стороны от каждого интересующего пика. Затем инструмент Wand использовался для определения площади, ограниченной пиком и базовой линией. Эти значения были определены как значения интенсивности для каждой выбранной неспецифической полосы.
Цифровое изображение блотов сначала было настроено на 8-битную шкалу серого, а затем был построен профиль интенсивности для каждой выбранной дорожки с использованием функции анализа гелей.Пики из неспецифических интересующих полос были идентифицированы, и базовая линия была создана, проведя прямую линию между двумя точками минимума по обе стороны от каждого интересующего пика. Затем инструмент Wand использовался для определения площади, ограниченной пиком и базовой линией. Эти значения были определены как значения интенсивности для каждой выбранной неспецифической полосы.
Иммуноферментный анализ
Набор для иммуноферментного анализа MicroVue SC5b-9 Plus (номер по каталогу A020; Quidel, Сан-Диего, Калифорния, США) использовали для экспериментов с иммуноферментным анализом (ELISA).Образцы наночастиц диоксида кремния, покрытые BSA, получали смешиванием равных объемов соответствующего раствора -1 BSA 1 мг / мл с 2 мг / мл наночастиц -1 диоксида кремния в Трис-буфере. Затем смеси инкубировали при 37 ° C в течение 2 часов с последующим центрифугированием при 16000 × g в течение 30 минут. Супернатанты удаляли, а наночастицы ресуспендировали в свежем Трис-буфере. Другой цикл центрифугирования и ресуспендирования был проведен с получением 1 мг / мл образцов наночастиц диоксида кремния -1 , покрытых BSA.Затем аликвоту 10 мкл каждого образца наночастиц диоксида кремния, покрытого BSA, смешивали с аликвотой 40 мкл свежеоттаявшей нормальной сыворотки человека (NHS). Аликвоту NHS объемом 50 мкл использовали в качестве отрицательного контроля (самый низкий уровень активации комплемента), а 10 мкл 1 мг / мл -1 наночастиц диоксида кремния без покрытия плюс 40 мкл NHS использовали в качестве положительного контроля (самый высокий уровень комплемента). активация). Все исследуемые образцы инкубировали при 37 ° C в течение 30 мин.
Затем смеси инкубировали при 37 ° C в течение 2 часов с последующим центрифугированием при 16000 × g в течение 30 минут. Супернатанты удаляли, а наночастицы ресуспендировали в свежем Трис-буфере. Другой цикл центрифугирования и ресуспендирования был проведен с получением 1 мг / мл образцов наночастиц диоксида кремния -1 , покрытых BSA.Затем аликвоту 10 мкл каждого образца наночастиц диоксида кремния, покрытого BSA, смешивали с аликвотой 40 мкл свежеоттаявшей нормальной сыворотки человека (NHS). Аликвоту NHS объемом 50 мкл использовали в качестве отрицательного контроля (самый низкий уровень активации комплемента), а 10 мкл 1 мг / мл -1 наночастиц диоксида кремния без покрытия плюс 40 мкл NHS использовали в качестве положительного контроля (самый высокий уровень комплемента). активация). Все исследуемые образцы инкубировали при 37 ° C в течение 30 мин.
Затем анализ выполняли с использованием 96-луночных планшетов, которые были предоставлены в наборе для ELISA, в соответствии с инструкциями производителя.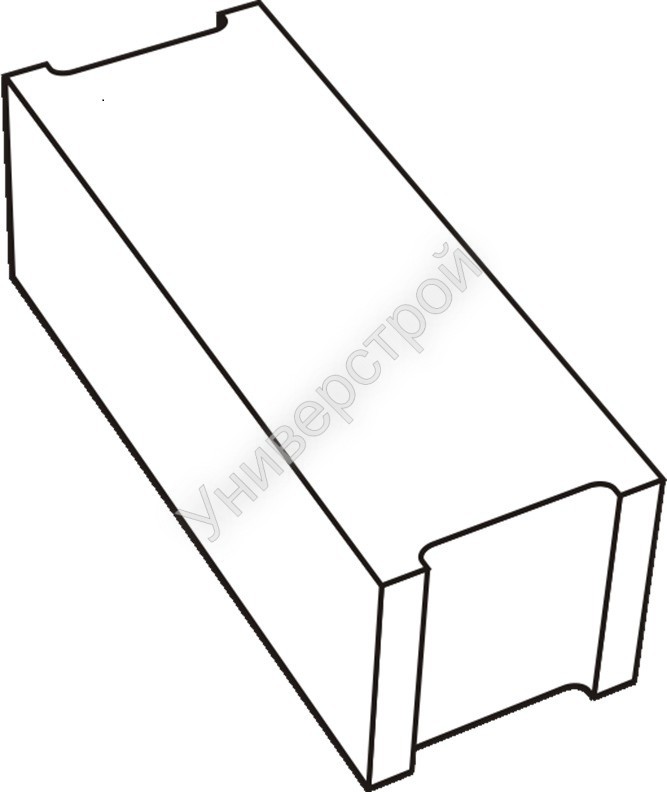 Все образцы сыворотки, включая контрольные, были разбавлены в 40 раз с использованием предоставленного раствора для разбавления образцов перед добавлением в лунки. Стандартные растворы добавляли без разбавления. Значения оптической плотности в каждой лунке определяли с помощью планшет-ридера Infinite Pro 200 (Tecan, Männedorf, Швейцария). Стандартные кривые рассчитывали путем сопоставления известных концентраций стандартных растворов с соответствующими значениями оптической плотности. Затем вычисляли концентрацию белка SC5b-9 в каждом образце.Степень защиты, обеспечиваемую каждым покрытием BSA, рассчитывали, рассматривая концентрации белка SC5b-9 из образцов отрицательного и положительного контроля как 100% и 0% защиты соответственно.
Все образцы сыворотки, включая контрольные, были разбавлены в 40 раз с использованием предоставленного раствора для разбавления образцов перед добавлением в лунки. Стандартные растворы добавляли без разбавления. Значения оптической плотности в каждой лунке определяли с помощью планшет-ридера Infinite Pro 200 (Tecan, Männedorf, Швейцария). Стандартные кривые рассчитывали путем сопоставления известных концентраций стандартных растворов с соответствующими значениями оптической плотности. Затем вычисляли концентрацию белка SC5b-9 в каждом образце.Степень защиты, обеспечиваемую каждым покрытием BSA, рассчитывали, рассматривая концентрации белка SC5b-9 из образцов отрицательного и положительного контроля как 100% и 0% защиты соответственно.
Статистический анализ
Статистический анализ проводился с использованием программного пакета GraphPad Prism (v8.0.1) от GraphPad Software (Ла-Холла, Калифорния, США). Односторонний или двусторонний дисперсионный анализ (ANOVA) с соответствующим тестом множественных сравнений и непарный t-тест использовали для вычисления статистической значимости экспериментальных данных, если это необходимо. Весь статистический анализ включал двусторонние тесты. Результаты непарных t-тестов представлены как значения P , тогда как результаты тестов множественных сравнений представлены как значения P с поправкой на множественность. P <0,05, P <0,01, P <0,001 и P <0,0001 указывают уровни статистической значимости. Дополнительную информацию можно найти в дополнительных таблицах 6-15.
Весь статистический анализ включал двусторонние тесты. Результаты непарных t-тестов представлены как значения P , тогда как результаты тестов множественных сравнений представлены как значения P с поправкой на множественность. P <0,05, P <0,01, P <0,001 и P <0,0001 указывают уровни статистической значимости. Дополнительную информацию можно найти в дополнительных таблицах 6-15.
Доступность данных
Все данные, подтверждающие выводы этого исследования, доступны в этой статье и файлах с дополнительной информацией, а также от соответствующих авторов по разумному запросу.
Благодарности
Авторы благодарят г-на Тун Нау Сута за техническую помощь с экспериментами QCM-D. Эта работа была поддержана Национальным исследовательским фондом Сингапура через грант программы конкурентных исследований (NRF-CRP10-2012-07) и грант на подтверждение концепции (NRF2015NRF-POC0001-19), а также Программой открытия творческих материалов через Национальный исследовательский фонд Кореи (NRF), финансируемый Министерством науки, ИКТ и планирования будущего (NRF-2016M3D1A1024098).
Каталожные номера
- 54.↵
- 55.↵
- 56.↵
- 57.↵
- 58.↵
- 59.↵
- 60.↵
- 61.↵
- 62.
- 63.
- 64.↵
Srour, B., Bruechert, S., Andrade, SL & Hellwig, P. в описании структуры и функций мембранного белка, 195–203 (Springer, 2017).
- 65.↵
Блокирование рецепторов Fc для проточной цитометрии
Хотя теоретически использование антител против рецепторов Fc (FcR) является лучшим способом устранения нежелательных сигналов, опосредованных связыванием FcR, вы не всегда можете иметь хорошо оптимизированный пул антител против FcR, сидящих прямо перед вами для вашего эксперимента.Кроме того, такой блокировщик может быть неприменим, если у вас есть один из FcR, например CD16, CD32 или CD64, для измерения в вашем канале. В этом блоге мы рассказываем о «старой школе» способа блокировки с помощью сыворотки, которая обычно доступна в большинстве лабораторий.
Блокирующий раствор был просто приготовлен путем добавления сыворотки здорового человека к PBS до конечной концентрации 10%. Чтобы провести сравнение с другим обычно доступным материалом, а именно с фетальной бычьей сывороткой (FBS), мы также приготовили 10% раствор FBS в PBS.PBMC от здорового донора инкубировали 10 минут с любым из этих блокирующих растворов или PBS в качестве неблокирующего контроля с последующей 30-минутной инкубацией с антителами в инкубационном буфере (0,5% BSA в PBS) и тремя промывками промывочным буфером FACS ( 5 мМ ЭДТА в PBS).
Для анализа моноциты и лимфоциты регистрировали с использованием прямого и бокового рассеяния. Чтобы исключить дублеты, одиночные клетки были заблокированы с использованием высоты и ширины прямого рассеяния, а затем высоты и ширины бокового рассеяния (рис. 1 A).
В результате, в то время как ожидаемый высокий процент (16,7%) неспецифического CD3 dim CD11b яркого сигнала, опосредованного FcR, был обнаружен в незаблокированном образце (рис. 1 B слева), блокирование с 10% либо FBS, либо человеческой сыворотки значительно уменьшили нежелательные сигналы (рис. 1B в центре и справа). Для дальнейшего сравнения эффектов блокирования между FBS и сывороткой человека популяция CD11b bright была стробирована и проанализирована на наличие сигнала CD3 под гистограммой (рис.2). Слегка сдвиг сигнала CD3 вправо в образце, заблокированном FBS, указывает на то, что сыворотка человека имеет лучшую эффективность блокирования, чем FBS.
1 B слева), блокирование с 10% либо FBS, либо человеческой сыворотки значительно уменьшили нежелательные сигналы (рис. 1B в центре и справа). Для дальнейшего сравнения эффектов блокирования между FBS и сывороткой человека популяция CD11b bright была стробирована и проанализирована на наличие сигнала CD3 под гистограммой (рис.2). Слегка сдвиг сигнала CD3 вправо в образце, заблокированном FBS, указывает на то, что сыворотка человека имеет лучшую эффективность блокирования, чем FBS.
У вас возникли вопросы по окрашиванию тетрамером? Новое руководство MBL International по окрашиванию тетрамеров представляет собой набор протоколов и данных, которые помогут сделать ваши эксперименты успешными. Руководство содержит более 90 страниц информации и включает продукты и советы по окрашиванию тетрамерами.
Шаг 5.2: Схема подключения FB
Кинематические функциональные блоки (FB)
Функциональные блоки «обеспечивают» движение, «обрабатывают» движение или идентифицируют детали как части движения и контуры эскиза (или контуры эскиза) как контуры движения.
Схема подключения функциональных блоков
На изображении символически показано, как можно соединить провода между функциональными блоками. | ||||||||||||||||||||
Провайдеры движения | Процессоры движения | Детали движения | ||||||||||||||||||
FB провайдера движения включают: «Функциональный блок линейного движения» перемещает по крайней мере первую кинематическую цепочку в редакторе механизмов. Диапазон значений от 0 до 360 (или чуть меньше) Вы можете использовать один выходной коннектор много раз или добавить FB линейного движения много раз. | FB процессора движения включают: Для каждого значения, заданного на входном коннекторе, MechDesigner «вычисляет» новое значение движения с внутренней функцией и параметрами. MechDesigner выдает новое значение движения на выходном коннекторе . Можно подключить несколько «процессоров движения» последовательно. Когда FB передачи находится сразу после FB линейного движения, он изменяет «частоту» MMA. | Детали движения:
Мы добавляем значения движения на входном соединителе к «Базовому значению». Функциональные блокиMotion-Dimension определяют расстояние или угол между двумя частями. | ||||||||||||||||||
Точки движения | ||||||||||||||||||||
Выходной «диапазон» из FB измерений или данных точки может быть независимой переменной для движения, части движения или точки движения. | Motion-Point
| |||||||||||||||||||
Примечания: Провайдеры движения
| Примечания: Процессоры движения
| Примечания: части движения и точки движения.
| ||||||||||||||||||
По мере того как NCAA сосредотачивается на численности персонала колледжа футбола, опрос показывает несоответствия
В Нотр-Даме самый большой футбольный персонал в стране, согласно опросу NCAA, проведенному исключительно CBS Sports.
А теперь немного в перспективе: номер Нотр-Дама, полученный в результате предварительного анализа следующего крупного исследования NCAA в отношении амбиций университетского футбола, определенно следует воспринимать с недоверием.
«Шесть или семь крупинок соли», — сказал Боб Боулсби, председатель комитета по надзору NCAA, который первым попробует рекомендовать ограничения по численности персонала.
Согласно опросу, распространенному в Совете NCAA в прошлом месяце, у ирландцев в общей сложности 45 полевых тренеров, силовых тренеров, ассистентов и вспомогательный персонал. За Нотр-Дамом в пятерке лидеров следуют Техас (44), Джорджия (42), Оберн (41) и Мичиган (40).
Однако NCAA сообщило CBS Sports, что методология измерения численности персонала 127 школ FBS в 2016 году была получена на основе простого исследования веб-сайтов.
Тренеры и реформаторы выразили протест по поводу размеров персонала, поскольку они связаны с конкурентным преимуществом. Боулсби сказал, что в прошлом месяце размер штата будет одним из двух предварительных вопросов, которые его комитет должен всесторонне рассмотреть в этом году.
Во время телефонной конференции в прошлом месяце Боулсби упомянул неназванную программу, в которой участвовало 97 сотрудников.
Bowlsby и председатель совета NCAA Джим Филлипс подчеркнули предварительный характер результатов опроса.Это говорит о том, что опрос — помимо того, что он проводится на ранней стадии — в лучшем случае является неполным, а иногда и неточным.
В тренерских кругах в основном считается, что самый большой штат имеет штат Алабама, а не Нотр-Дам. Согласно опросу, штат Алабама составляет 31 человек. Согласно результатам опроса, штат Миссури и Оле Мисс занимают шестое место в рейтинге SEC и 28 место в национальном масштабе.
Согласно результатам опроса, штат Миссури и Оле Мисс занимают шестое место в рейтинге SEC и 28 место в национальном масштабе.
Багровому приливу считается всего один сотрудник по силе и кондиционированию.Быстрая проверка собственного веб-сайта Алабамы показывает, что в программе NCAA задействованы максимум пять силовых тренеров.
«Нам нужно кое-что сделать», — сказал Боулсби, комментируя предварительные результаты опроса.
Школы допускаются максимум к девяти тренерам на поле, этим пяти тренерам силы и четырем помощникам выпускников. Однако в последние годы в состав вспомогательного персонала вошли так называемые аналитики, консультанты, специалисты по связям с игроками и типы персонала игроков — даже добровольцы.
Персоналу поддержки не разрешается взаимодействовать с игроками на поле во время тренировок или игр.
Количество добавленного вспомогательного персонала не ограничено. Фактически, некоторые утверждают, что NCAA должно ограничивать численность персонала, даже когда они пытаются определить, может ли такое ограничение быть введено на законных основаниях.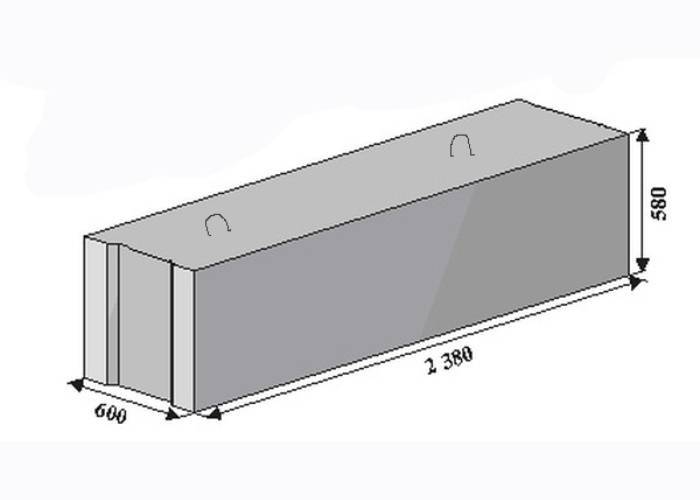
«Понятно», — сказал Филлипс, также спортивный директор Northwestern. «Может быть, вы не можете ограничить [это], но идея в том, что мы так структурировали себя в прошлом.Вот почему у нас нет семи помощников тренеров по баскетболу ».
В баскетболе Дивизиона I лимит составляет три штатных помощника. В прошлом месяце NCAA утвердила 10-го штатного помощника тренера по футболу. Этот шаг вступает в силу в январе
«Конечно, вы можете [ограничить штат сотрудников], — сказал Тодд Берри, исполнительный директор Ассоциации тренеров по американскому футболу. «… Есть основания полагать, что судебный процесс вызывает опасения. NCAA, как и все остальные, опасается.»
В опросе персонал разбит на пять категорий: тренеры на поле, сила и физическая подготовка, ассистенты, футбольные операции и вне поля / набор персонала.
Первые три категории считаются статическими числами, ограниченными NCAA. Это последняя две категории — футбольные команды и вне поля / рекрутинг — без ограничений.
Если использовать только эти цифры вспомогательного персонала, Джорджия (23) занимает первое место в опросе, за ней следуют Клемсон (22), Мичиган (22), Техас (22) и Алабама (20).
Нотр-Дам приписывают 19 вспомогательных сотрудников.
«Я думаю, это паранойя, которая есть у всех нас, что кто-то другой делает что-то, что мне разрешено, и всем остальным разрешено делать», — сказал Ник Сабан репортерам в прошлом месяце, — «но вы выбираете это делать».
Тренер из Техаса Том Херман ранее в этом месяце подробно рассказал журналистам о своем вспомогательном персонале из 17 человек: «четыре ассистента выпускника, четыре специалиста по контролю качества, трое на производстве, один в качестве нашего директора по развитию игроков, трое на полной ставке в сфере набора персонала, трое на полной должности. время в творческих медиа.«
В Техасе самый большой спортивный бюджет в стране — более 160 миллионов долларов.
«Ограничения не должны наказывать школы, которые могли бы иметь больше доходов и позволить себе подобный персонал», — сказал Герман.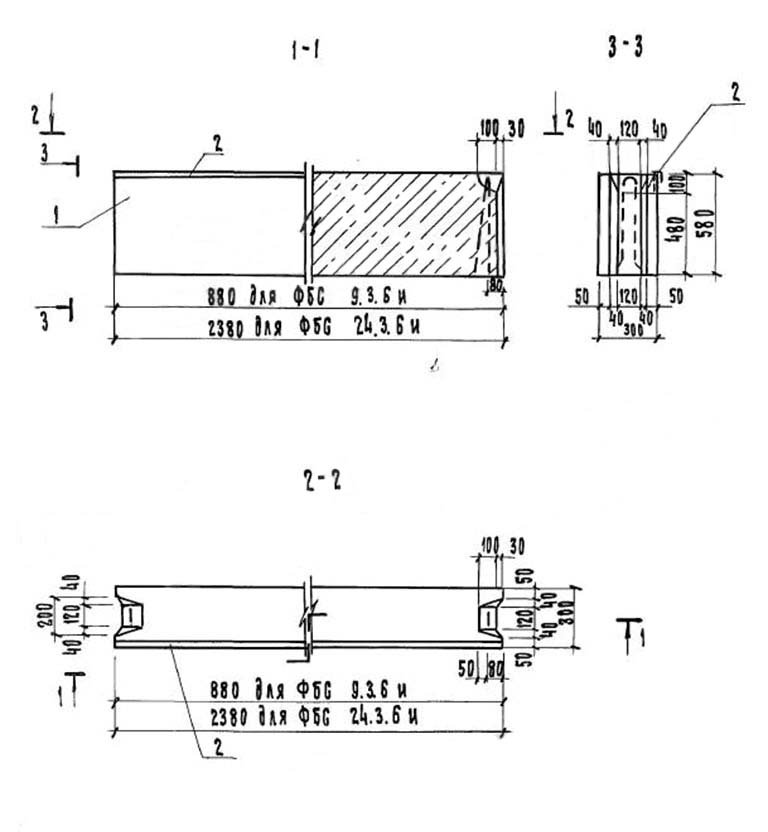 «В какой-то момент это становится немного смешным».
«В какой-то момент это становится немного смешным».
Тренер из Вайоминга Крейг Бол сказал, что несколько лет назад среди тренеров было общее движение к тому, чтобы ограничить штат до 25 человек.
«Я не думаю, что сейчас это будет реальным числом», — сказал Бол.«Я думаю, что моя цель — просто убедиться, что тренерский номер тот же, количество ребят, которые могут покинуть кампус, такое же.
«В остальном, тот, у кого есть ресурсы, чтобы делать все, что они могут сделать, прекрасно».
Филипса спросили, можно ли заставить программы передавать информацию о численности персонала в NCAA.
«Я думаю, что крайне важно, чтобы люди были предельно честны в отношении того, сколько людей они работают с футболом», — сказал он.«Если люди хотят скрыть и сказать полуправду о том, какой на самом деле размер их штата, это не поможет нам найти хорошее место для всех».
Среди конференций Группы пяти, Темпл и Хьюстон были лидерами с общим числом сотрудников 30 человек. Тулейн и Толедо (28), а также Трой, Бойсе и Западный Кентукки (27) последовали за ними.
Тулейн и Толедо (28), а также Трой, Бойсе и Западный Кентукки (27) последовали за ними.
Неудивительно, что существует четкое разграничение между средней численностью персонала в Power Five и Group of Five.
Большой Тен | 31.6 |
SEC | 31,5 |
ACC | 29,0 |
9055 | |
Большой 12 | |
Американский | 25,0 |
MAC | 21,5 |
Conference USA | Конференция США0|
Sun Belt | 20.9 |
Mountain West | 20.3 |
Phoenix Contact FBS 2-10 — концевой блок
Phoenix Contact FBS 2-10 — вставной мост для клеммных блоков | 3005947
Разное
Тип продукта
клеммный блок вставной мост
Категория аксессуара
кабельная разводка и кабельные аксессуары
Цвет
красный
Количество предметов в упаковке
10
Заголовок
Марка
Phoenix Contact
Линия продуктов
Phoenix Contact
Модель
FBS 2-10
Количество в упаковке
1
Общий
Производитель
Phoenix Contact
Новая популяция внеклеточных везикул меньше экзосом способствует пролиферации клеток | Клеточная коммуникация и передача сигналов
Везикулы, идентифицированные во фракции P200, меньше экзосом
Многочисленные предыдущие исследования рассматривали фракцию P100, полученную в результате ультрацентрифугирования при 100000 × g, как фракцию экзосом [19, 27, 28, 30].Однако неизвестно, есть ли какие-либо неидентифицированные группы везикул в супернатанте SN Δ после центрифугирования 100 000 × g [19]. Чтобы проверить, имеет ли эта фракция супернатанта (далее именуемая SN Δ1 ) какие-либо EV, SN Δ1 впоследствии центрифугировали при 200000 × g, чтобы получить осадок P200 и фракции супернатанта SN Δ2 (рис. 1a).
Затем мы непосредственно визуализировали везикулы во фракциях P100 и P200, приготовленных из среды для культивирования клеток HEK293, с помощью просвечивающей электронной микроскопии (ТЕМ) и сканирующей электронной микроскопии окружающей среды (ESEM).Микрофотографии ПЭМ фракции P100 показали везикулы диаметром от 20 до 150 нм (рис. 1b, d). С другой стороны, везикулы во фракции P200 были меньше, чем везикулы во фракции P100 (рис. 1b ’, d). Разница в размерах везикул во фракциях P100 и P200 также была очевидна на изображениях ESEM (рис. 1c, c ’). Аналогичные результаты были получены с CM клеток Drosophila S2 (дополнительный файл 1: фиг. S1c, c ’, d), предполагая, что секреция этих более мелких везикул P200 эволюционно консервативна.Мы также подтвердили, что SN Δ1 содержит везикулы, размеры которых аналогичны везикулам P200, но не более крупным везикулам P100 (дополнительный файл 1: рисунок S1a ’, b’). Не было обнаружено видимых пузырьков во фракции SN Δ2 (дополнительный файл 1: рисунок S1a ”, b”) и во фракции осадка после повторного центрифугирования SN Δ2 при 200000 × g (дополнительный файл 1: рисунок S1a » ‘, б ”’). Эти результаты предполагают, что CM не содержит других более мелких везикул, чем везикулы P200.
Мы дополнительно исследовали везикулы во фракциях P100 и P200 с помощью анализа отслеживания наночастиц (NTA).Фракции P100 и P200 имели везикулы с явно разными размерами (рис. 1e), что напоминает результаты, полученные с помощью EM. Диаметр везикул в основном пике составлял 138,3 нм во фракции P100 и 80,9 нм во фракции P200. Измерение размера как с помощью NTA, так и с помощью EM ясно демонстрирует, что фракция P200 содержит везикулы меньшего размера, чем экзосомы, хотя размеры везикул, полученные из изображений TEM, были меньше, чем у NTA, как сообщалось ранее [31]. Кроме того, данные NTA подтвердили, что везикулы отсутствуют в SN Δ2 и в осадке, полученном в результате центрифугирования SN Δ2 при 200000 × g (дополнительный файл 1: рисунок S1e).
Биогенез везикул во фракции P200 отличается от экзосом
Множественные типы EV генерируются разными механизмами [15], и экзосомы высвобождаются во внеклеточное пространство путем слияния MVB с плазматической мембраной [16, 32, 33,34,35]. Сообщается, что ряд химических веществ, таких как Брефельдин A (BFA) и GW4869, блокирует важный этап секреции экзосом [36,37,38]. BFA ингибирует белок обмена гуаниновых нуклеотидов BIG2, который регулирует конститутивное высвобождение экзосомоподобных везикул [39, 40].GW4869 является ингибитором нейтральной сфингомиелиназы (N-SMase), который отрицательно действует на опосредованное церамидами внутреннее почкование MVB и высвобождение зрелых экзосом [37, 41].
Мы предположили, что везикулы P200 образуются с помощью особого механизма, а не просто представляют собой экзосомы меньшего размера. Поэтому мы проверили, блокируют ли эти ингибиторы секреции экзосом секрецию везикул в P100, но не в P200. Обработка BFA клеток HEK293 уменьшала количество частиц во фракции P100 до 1/10 по сравнению с отсутствием обработки (рис.2а, в). Сравнимый результат был получен при обработке клеток HEK293 GW4869 (рис. 2d, f). Напротив, ни обработка BFA, ни GW4869 существенно не уменьшала количество везикул во фракции P200 (рис. 2b, c, e, f). Обработка BFA и GW4869 не изменила ни количество, ни размер везикул, которые уже были секретированы в среду, что указывает на то, что эти препараты внутриклеточно влияют на биогенез и секрецию экзосом, но не на секретируемые внеклеточные экзосомы (дополнительный файл 1: Рисунок S1f, g) .Эти результаты показывают, что BIG2- и N-SMase-зависимый путь является основным путем, с помощью которого продуцируются везикулы P100, но не P200. Следовательно, везикулы во фракциях P100 и P200 различаются не только по размеру, но и по основному пути биогенеза.
CD81 высоко обогащен экзосомами, но не везикулами P200
Мы пришли к выводу, что некоторые маркеры экзосом среди Hsp70, TSG101, CD63 и CD81 могут не присутствовать в P200, если более мелкие EV отличаются от экзосом [16, 18, 24] .Чтобы проверить это, мы приготовили фракции P100, P200 и SN Δ2 из КМ клеток HEK293 путем ультрацентрифугирования. Когда для культивирования использовались среды, содержащие 10% FBS, концентрированные образцы SN Δ2 не попадали в гели SDS-PAGE, предположительно из-за высокого содержания белков сыворотки. Чтобы обойти эту проблему, клетки HEK293 культивировали в среде SF, а затем через 24 часа собирали CM. Мы обнаружили, что Hsp70 и TSG101 присутствовали во фракциях P100, P200 и SN Δ2 (рис.3а, б, дополнительный файл 8: рисунок S8a, б). CD63 был обнаружен во фракциях P100 и P200, и результаты иммуно-ЭМ подтвердили, что CD63 присутствует на мембранной структуре везикул P100 и P200 (фиг. 3c, f, g, дополнительный файл 2: фигура S2 h, i). С другой стороны, CD63 не был обнаружен во фракции SN Δ2 (фиг. 3c, дополнительный файл 8: фиг. S8c). Это, по-видимому, отражает природу CD63 как трансмембранного белка, который, вероятно, связан с везикулярной структурой, присутствующей в P100 и P200.
Рис. 3Фракции P100 и P200 содержат разные уровни маркеров экзосом. ad Субфракции получали из CM клеток HEK293, выращенных в условиях SF в течение 72 часов с помощью ультрацентрифугирования, и использовали для вестерн-блоттинга для проверки следующих маркеров экзосом: ( a ) Hsp70, ( b ) TSG101, () c ) CD63 и ( d ) CD81 (SBI, кролик). Красная стрелка указывает ожидаемый размер целевого белка на каждой панели. e Вестерн-блоттинг фракций P100 и P200 из CM HEK293, культивированных в среде 10% FBS с использованием антитела против CD81.Красная стрелка указывает белок CD81. f , г Репрезентативные ПЭМ-изображения везикул в ( f ) P100 и ( г ) P200 из HEK293 CM, меченные частицами золота 10 нм, полученные в результате окрашивания антителом против CD63 и антителом кролика антитело, конъюгированное с золотом. Красные стрелки указывают белок CD63. Исходные полные блоты представлены в дополнительном файле 8: Рисунок S8a-e
Наличие или отсутствие этих экзосомных маркеров во фракциях P100, P200 и SN Δ2 , приготовленных ультрацентрифугированием, было аналогично тем, которые были приготовлены в колонке исключения размера qEV (дополнительный файл 2: Рисунок S2a-c, fg).Поскольку более крупные экзосомы отделяются первыми от столбца исключения по размеру, известно, что фракции с 7 по 9 содержат экзосомы. Меньшие ЭВ, по-видимому, элюировались в фракциях с 10-й по 12-ю, опережая большое количество растворимых белков в более поздних фракциях (дополнительный файл 2: рисунок S2a). Hsp70 присутствовал во всех фракциях qEV после 7-й фракции, тогда как CD63 обнаруживался только в 7–12-й фракциях (дополнительный файл 2: рисунок S2b, c, дополнительный файл 9: рисунок S9a, b).Эти два независимых метода показывают аналогичные результаты по распределению этих маркеров экзосом в разных фракциях.
Наше исследование с использованием нескольких маркеров экзосом выявило, что CD81 сильно обогащен фракцией P100 (т.е. экзосомами), но не фракциями P200 (т.е. малыми ЭВ) и SN Δ2 (т.е. растворимыми белками), с использованием двух различных антитела к CD81 (рис. 3d, e; дополнительный файл 2: рисунок S2d, дополнительный файл 9: рисунок S9c). Кроме того, CD81 был обогащен P100, но не фракцией P200, полученной из CM линии клеток моноцитарного лейкоза человека THP-1 (дополнительный файл 2: рисунок S2e, дополнительный файл 9: рисунок S9d).Обогащение CD81 во фракции P100 может быть специфичным для клеточной линии, но эта тенденция неоднократно наблюдалась для клеточных линий HEK293 и THP-1. CD81-положительные полосы также постоянно обнаруживались во фракциях с 7 по 9 qEV, полученных из CM клеток HEK293, выращенных либо в среде SF, либо в среде 10% FBS (дополнительный файл 2: рисунок S2f, g, дополнительный файл 9: рисунок S9e, f), сочувствуя, что CD81 обогащен более крупными везикулами, чем везикулы P200. Мы пришли к выводу, что более мелкие EV действительно представляют собой недавно идентифицированную группу EV, отличную от экзосом, и что CD81 обогащен специфически в экзосомах, но не в маленьких пузырьках (т.е.е., P200), присутствующие в CM культуры клеток HEK293.
Фракция P100 способствует продукции экзосом, тогда как фракция P200 поддерживает пролиферацию клеток.
Затем мы спросили, могут ли фракции P100 и P200 вызывать различные клеточные функции при попадании в среду для культивирования клеток. Сначала мы приготовили фракции P100 и P200 из HEK293 CM, культивируемого в среде SF, для специфического получения везикул, секретируемых из клеток HEK293, поскольку FBS содержит экзосомы крупного рогатого скота [42]. Мы растворили эти фракции осадка в среде SF и измерили количество экзосом с помощью NTA перед тем, как внести их в культуру клеток, чтобы получить EV 0h .Искусственные липосомы использовали в качестве отрицательного контроля. Через 48 часов измеряли количество клеток и экзосом (EV 48h ) в среде (рис. 4а). Мы обнаружили, что количество клеток значительно увеличилось при добавлении P200, но не при добавлении каких-либо других добавок (рис. 4b, синие стрелки), что позволяет предположить, что P200 способен стимулировать пролиферацию клеток.
Рис. 4Фракция Р100 способствует секреции экзосом, а фракция Р200 способствует пролиферации клеток. a Схема, демонстрирующая экспериментальную процедуру.Свежую среду SF, фракции SF + P100 и SF + P200 подавали в такое же количество клеток THP-1 и клеток HEK293. Через 48 ч культивирования подсчитывали количество экзосом и клеток. b-d Фракции P100 и P200 получали из HEK293 CM (SF) и добавляли в среду SF. Липосомы добавляли в качестве отрицательного контроля. Гистограммы показывают ( b ) окончательное количество клеток, ( c ) количество экзосом на клетку и ( d ) чистое производство экзосом на клетку (EV 48h — EV 0h ) культуры клеток HEK293 после каждого добавления.( e , f ) Клетки HEK293 обрабатывали фракциями, полученными из 10% FBS. Гистограммы показывают ( e ) конечное количество клеток THP-1 (темно-зеленый) и HEK293 (светло-зеленый) и ( f ) количество экзосом, нормализованное к конечному количеству клеток. г, ч. Клеток THP-1 или HEK293 обрабатывали фракциями, полученными из HEK293 CM, культивированных в 10% FBS. Гистограммы показывают ( г, ) конечное количество клеток для клеток THP-1 (темно-синий) и HEK293 (светло-синий) и ( ч ) количество экзосом, нормализованное к конечному количеству клеток.Красные и синие стрелки указывают на отмеченные эффекты фракций P100 и P200 соответственно. Эксперименты повторяли 3–6 раз, в каждом из которых было 6 технических повторов. Результаты отображаются в виде среднего значения ± S.E.M. * Достоверная разница проанализирована с помощью t-критерия (* p <0,05, ** p <0,01, *** p <0,001). + p <0,1 и нс = не значимо. SF = без сыворотки
В случае продукции экзосом поставка P100, но не P200 из клеток HEK293 значительно увеличила количество высвобождаемых экзосом на клетку (EV 48h на клетку) по сравнению с контрольными SF (рис.4c; Красная стрела). Аналогичным образом, количество экзосом на мл среды увеличивалось только за счет добавления P100 (дополнительный файл 3: рисунок S3a). Вычитая количество экзосом, которые поставляются изначально (EV 0h на клетку) из EV 48h , мы получили чистую продукцию EV (EV 48h — EV 0h ). Это значение было существенно увеличено за счет добавления P100, но не P200 (рис. 4d; дополнительный файл 3: рис. S3b). Напротив, чистая продукция P200 осталась неизменной при добавлении везикул P200 (дополнительный файл 5: рисунок S5 g).Это говорит о том, что добавление P200 не способствует производству P200. В целом, внеклеточное добавление экзосом из клеток HEK293 способствует дополнительной продукции экзосом в гораздо большей степени, чем то, что клетки HEK293 выделяют без экзосом в контроле SF (рис. 4c, d).
Известно, что FBS содержит немалое количество эндогенных экзосом крупного рогатого скота [42]. Мы проверили, может ли FBS способствовать дополнительной продукции экзосом из человеческих клеток. NTA подтвердило, что существует 1 ~ 10 × 10 8 частиц на мл во фракции P100, приготовленной из свежей среды 10% FBS (дополнительный файл 4: рисунок S4d, дополнительный файл 5: рисунок S5b).Количество экзосом незначительно варьировалось между партиями FBS и методами приготовления (данные не показаны). Когда клетки HEK293 и THP-1 выращивали в 10% FBS в течение 48 часов, количество экзосом на мл среды и на клетку резко увеличивалось по сравнению с условиями SF (дополнительный файл 4: рисунок S4a-c). Чистое увеличение количества экзосом в HEK293 CM, выращенных в среде с 10% FBS в течение 48 часов, было намного больше, чем количество первоначально предоставленных экзосом в свежей среде с 10% FBS (дополнительный файл 4: Рисунок S4d; сравните два смежных заштрихованных красным и твердый).Эти данные предполагают, что экзосомы крупного рогатого скота в FBS могут индуцировать продукцию экзосом человеческими клетками.
Мы специально исследовали, могут ли экзосомы P100 и маленькие везикулы P200, происходящие из FBS, вызывать продукцию экзосом и пролиферацию клеток, соответственно, двух линий клеток человека, HEK293 и THP-1. Для ответа на этот вопрос были приготовлены два разных набора фракций P100 и P200: один набор из FBS, а другой из CM HEK293, культивированного в среде 10% FBS. Мы обнаружили, что фракции P200 из обоих наборов заметно увеличивают пролиферацию клеток по сравнению с контролем SF для обеих клеточных линий (рис.4д, ж, синие стрелки). С другой стороны, фракции P100 из обоих наборов положительно влияли на продукцию экзосом (фиг. 4f, h, дополнительный файл 3: фиг. S3e, g, красные стрелки). Эти обработки не повлияли на жизнеспособность клеток линий клеток THP-1 и HEK293 (дополнительный файл 6: рисунок S6a, b). В заключение, фракции экзосом из FBS и HEK293 CM (10% FBS и SF) способствуют продукции экзосом, тогда как фракции P200 поддерживают пролиферацию клеток двух линий клеток человека.
Следует отметить одно интересное открытие: фракции Р100 и Р200 бычьего происхождения могут функционировать в линиях клеток человека.Мы дополнительно протестировали межвидовой эффект с клеточной линией Drosophila S2. Когда фракции P100 и P200 из HEK293 CM были добавлены в искусственную среду, содержащую сыворотку для культуры клеток S2, мы не наблюдали никаких изменений в высвобождении экзосом, пролиферации или жизнеспособности клеток (дополнительный файл 3: рисунок S3i-l).
Чтобы лучше понять влияние FBS и его экзосом крупного рогатого скота на клетки, клетки культивировали в различных концентрациях (0, 2,5, 5, 10%) FBS в течение 48 часов. NTA точно измерил количество экзосом в этих свежих средах FBS (EV 0h ), которые пропорционально увеличивались с концентрацией FBS (дополнительный файл 5: Рисунок S5b).Каждую из этих сред FBS (0, 2,5, 5, 10%) подавали в клетки HEK293, а затем через 48 часов измеряли количество экзосом в CM (EV 48h ) (дополнительный файл 5: Рисунок S5c, e) . Расчетная чистая продукция (EV 48h — EV 0h на клетку и на мл) четко демонстрирует, что FBS в среде усиливает продукцию клеток экзосомами (дополнительный файл 5: Рисунок S5, d, f). Как и ожидалось, FBS поддерживает пролиферацию клеток (дополнительный файл 5: рисунок S5a). Эти объединенные данные демонстрируют, что экзосомы крупного рогатого скота, содержащие FBS, усиливают продукцию экзосом из клеток человека.
Мы пришли к выводу, что экзосомы крупного рогатого скота могут поглощаться человеческими клетками, чтобы влиять на их секрецию экзосом. Чтобы проверить это, мы культивировали клетки HEK293 и THP-1 в свежей среде SF и в среде SF плюс фракцию P100, полученную из FBS. Затем мы собрали эти CM и измерили количество везикул в P100 из каждого CM в шести различных временных точках (0 = до контакта с клетками, 1, 2, 6, 24, 48 ч после культивирования). В условиях SF в качестве контроля количество экзосом неуклонно увеличивалось в течение 1-6 часов культивирования (дополнительный файл 4: рисунок S4e, f; серая пунктирная линия), вероятно, из-за секреции новых экзосом.Напротив, в состоянии SF плюс P100 количество экзосом первоначально уменьшалось в течение часа, но со временем увеличивалось (дополнительный файл 4: рисунок S4e, f; красная пунктирная линия). О такой быстрой интернализации внеклеточных экзосом сообщалось ранее [43, 44]. Интересно, что искусственные липосомы, размер и концентрация которых совпадают с размером и концентрацией аналога P100, продемонстрировали несколько ослабленное начальное снижение и в конечном итоге не смогли вызвать чистое увеличение продукции экзосом (дополнительный файл 4: рисунок S4e, f; оранжевая пунктирная линия).Эти данные предполагают, что предоставленные экзосомы крупного рогатого скота поглощаются человеческими клетками в течение часа и, в свою очередь, стимулируют продукцию экзосом.
Истощение P100 и P200 снижает продукцию экзосом и пролиферацию клеток, соответственно.
Чтобы подтвердить наши выводы о дифференциальных функциях двух разных групп EV, мы разработали серию дополнительных экспериментов. Вместо фракций гранул P100 и P200 мы приготовили три фракции супернатанта: SN 0 , SN Δ1 (= SN 0 -P100) и SN Δ2 (= SN Δ1 -P200) из HEK293. CM (SF) (рис.5а). Кроме того, фракция P100, выделенная из HEK293 CM (SF), была добавлена к соответствующему SN Δ2 для получения «SN Δ2 + P100». Затем каждый из них непосредственно наносили на клетки HEK293, и количество клеток и экзосом в среде измеряли через 48 часов культивирования (рис. 5а). Мы обнаружили, что конечное количество клеток было значительно снижено в SN Δ2 по сравнению с SN Δ1 (рис. 5b, синяя стрелка). С другой стороны, различия в количестве ячеек между SN 0 по сравнению с SN Δ1 и между SN Δ2 по сравнению с SN Δ2 + P100 остались неизменными (рис.5b; красные стрелки). Согласованные результаты были получены при добавлении фракций супернатанта 10% FBS и HEK293 CM (10% FBS) к культурам клеток THP-1 и HEK293 (фиг. 5e, g, синие стрелки). Таким образом, истощение P200 во фракции SN Δ2 по сравнению с истощением P100 во фракции SN Δ1 препятствовало пролиферации клеток.
Рис. 5Истощение фракции P100 снижает продукцию экзосом, в то время как истощение фракции P200 снижает пролиферацию клеток. a Схема для демонстрации экспериментальных процедур.Фракции SN 0 , SN Δ1 , SN Δ2 и SN Δ2 + P100, полученные из культуральной среды HEK293 CM и 10% FBS, вводили в культуру клеток THP-1 или HEK293. b-d Когда клетки HEK293 обрабатывали фракциями, полученными из HEK293 CM, культивированных в SF. Гистограммы показывают ( b ) окончательное количество клеток, ( c ) количество экзосом на клетку и ( d ) чистое производство экзосом (EV 48h — EV 0h ).Клетки e , f HEK293 обрабатывали фракциями, полученными из HEK293 CM, культивированных в 10% FBS. Гистограммы показывают ( e ) конечное количество клеток и ( f ) количество экзосом на конечное количество клеток для клеток THP-1 (темно-зеленый) и HEK293 (светло-зеленый). г , ч Клетки HEK293 обрабатывали фракциями, полученными из HEK293 CM, культивированных в 10% FBS. Гистограммы показывают ( г, ) конечное количество клеток и ( ч ) количество экзосом на клетку THP-1 (темно-синий) и HEK293 (голубой).Красные и синие стрелки указывают на незначительные эффекты P100 и значительные эффекты от добавления P200, соответственно. Эксперименты повторяли 3–6 раз, в каждом из которых было 6 технических повторов. Результаты отображаются в виде среднего значения ± S.E.M. * Достоверная разница проанализирована с помощью t-критерия (* p <0,05, ** p <0,01, *** p <0,001). + p <0,1 и ns = незначительно
Затем мы исследовали влияние вышеупомянутых фракций на продукцию экзосом.После 48 ч культивирования в SN 0 из HEK293 CM (SF) клетки HEK293 продуцировали большое количество экзосом по сравнению с контролями SF. Продукция экзосом на клетку (EV 48h ) была снижена в SN Δ1 , в котором отсутствует P100, по сравнению с SN 0 , но увеличилась в SN Δ2 + P100 по сравнению с SN Δ2 (рис. 5c, красные стрелки. ). Фракции SN Δ1 и SN Δ2 не показали значительных различий в продукции экзосом, что указывает на то, что истощение P200 не влияет на продукцию экзосом (рис.5c; синие стрелки). Аналогичные результаты были получены, когда учитывались чистая продукция (EV 48h — EV 0h ) (рис. 5d; красные стрелки) и количество экзосом на мл (дополнительный файл 3: рис. S3c, d). Когда культуры клеток THP-1 и HEK293 обрабатывали фракциями из 10% FBS и HEK293 CM (10% FBS), были получены аналогичные результаты со сравнимой жизнеспособностью клеток (рис. 5f, h; красные стрелки и синие стрелки, дополнительный файл 3: Рисунок S3f, h; Дополнительный файл 6: Рисунок S6c, d).Следовательно, экзосомы, компонент, обедненный SN Δ1 по сравнению с SN 0 , вносят вклад в продукцию экзосом.
Истощенная экзосомами FBS способствует пролиферации клеток, но не продукции экзосом
До сих пор мы показали, что внеклеточные экзосомы способствуют продукции экзосом, а более мелкие EV поддерживают пролиферацию клеток. Чтобы подтвердить наши выводы, мы использовали ED-FBS в культуре клеток и изучили его влияние на продукцию экзосом и пролиферацию клеток. Количество экзосом в свежей среде с 10% ED-FBS действительно было намного меньше, чем в свежей среде с 10% FBS (дополнительный файл 4: рисунок S4d; сравните заштрихованные синим и красным цветом).Соответственно, фракция P100, полученная из 10% ED-FBS, имела значительно более низкий уровень Hsp70, чем фракции, полученные из 10% FBS, тогда как фракции P200, полученные из этих двух источников, показали сопоставимые уровни Hsp70 (рис. 6a, дополнительный файл 8: рис. S8f). Количество частиц во фракции P200 10% ED-FBS также было сравнимо с числом частиц 10% FBS (фиг. 6b). Таким образом, мы подтвердили, что P100 (экзосомы), но не P200 (небольшие EV) истощены в ED-FBS.
Рис. 6FBS с истощенной экзосомой способствует пролиферации клеток, но не продукции экзосом. Вестерн-блот фракций P100 и P200, выделенных из свежей среды с 10% FBS и 10% ED-FBS, для обнаружения Hsp70. b Количество частиц во фракциях P200 в различных средах: SF, 10% ED-FBS, 10% FBS. c Фракции P100, выделенные из HEK293 CM в различных условиях культивирования: SF, 10% FBS, 10% ED-FBS. Показаны уровни Hsp70. d Количество клеток HEK293, культивируемых в различных средах: SF, 10% FBS, 10% ED-FBS. e, f Свежую среду SF, липосомы SF +, фракции SF + P100 и SF + P200, полученные из 10% среды ED-FBS, подавали в такое же количество клеток THP-1 (темно-серые).Фракции SN 0 , SN Δ1, SN Δ2 и SN Δ2 + P100, приготовленные из 10% среды ED-FBS, подавали в клетки THP-1 (светло-серые). ( e ) Конечное количество клеток в культуре клеток THP-1 и ( f ) количество экзосом, нормализованное по конечному количеству клеток. Синие стрелки указывают на отмеченные эффекты от добавления P200, а красные стрелки указывают на незначительные изменения от добавления P100. Эксперименты повторяли 3–6 раз, в каждом из которых было 6 технических повторов.Результаты отображаются в виде среднего значения ± S.E.M. * Достоверная разница проанализирована с помощью t-критерия (* p <0,05, ** p <0,01, *** p <0,001). ns = не имеет значения. Полные исходные блоты представлены в дополнительном файле 8: Рисунок S8f, g
Когда клетки HEK293 культивировали в 10% среде ED-FBS или условиях SF, было получено аналогичное количество экзосом (дополнительный файл 4: Рисунок S4d; сравните серый и синий сплошные стержни). Уровень Hsp70 также был намного ниже, когда клетки культивировали в SF или 10% ED-FBS, чем в 10% FBS (рис.6c, дополнительный файл 8: рисунок S8g). Напротив, клетки HEK293 продемонстрировали устойчивую пролиферацию клеток в среде 10% ED-FBS, сравнимую с таковой в среде 10% FBS (фиг.6d), что указывает на то, что ED-FBS столь же эффективен, как и FBS, в поддержании пролиферации клеток (фиг. 6d, дополнительный файл 6: рисунок S6e). Это открытие согласуется с нашими предыдущими данными о том, что небольшие EV во фракции P200 увеличивают пролиферативную способность клеток.
Для дальнейшего подтверждения дифференциальных функций этих двух типов EV мы приготовили ультрацентрифужные фракции из 10% ED-FBS сред и исследовали их влияние на продукцию экзосом и пролиферацию клеток в культурах клеток THP-1 и HEK293.Поскольку в ED-FBS практически отсутствуют экзосомы, ожидается, что эффекты фракции P100 будут отсутствовать в ED-FBS. Соответственно, добавление ни фракций P100, ни P200 не привело к каким-либо значительным изменениям в количестве секретируемых экзосом по сравнению с контролем SF как для THP-1 (рис. 6f, красные стрелки; дополнительный файл 7: рис. S7 g), так и для клеток HEK293. (Дополнительный файл 7: рисунок S7a, b, e). Что касается пролиферации клеток, конечное количество клеток показало умеренное, но статистически значимое увеличение при добавлении P200, полученного из ED-FBS, что указывает на то, что небольшие EV присутствуют в ED-FBS (рис.6e; синие стрелки). Следовательно, ED-FBS утратил способность продуцировать экзосомы, но сохранил способность к пролиферации клеток, поскольку в ED-FBS отсутствуют экзосомы, но не более мелкие EV.
Мы также приготовили фракции из CM клеток HEK293, культивированных в 10% ED-FBS, которые содержат небольшое количество экзосом (дополнительный файл 4: рисунок S4d), и исследовали влияние этих фракций на культуру клеток HEK293. Как и ожидалось, наблюдался положительный эффект фракции P200 на пролиферацию клеток (дополнительный файл 7: рисунок S7c).Однако, в отличие от фракции P100 из свежего 10% ED-FBS, продукция экзосом была усилена P100 из CM клеток HEK293 (10% ED-FBS), вероятно, из-за более высокого количества экзосом, чем свежий 10% ED-FBS ( Дополнительный файл 7: рисунок S7d, f). В целом эти данные демонстрируют, что экзосомы дополнительно способствуют продукции экзосом, а более мелкие EV усиливают пролиферацию клеток.
cobol — В чем разница между форматом с переменной блокировкой и форматом с фиксированной блокировкой?
Забудьте все, что вы знаете о данных на жестком диске под Windows или Unix / Linux.
Записи фиксированной длины (которые могут быть в формате записи (RECFM) F для разблокировки, FB для заблокированных (они также могут быть FBS, что является стандартом фиксированного блока, но для простого одноразового набора данных (файла) он эквивалентен FB) содержат только данные, а также известный и неизменный объем данных.
Данные, которые они содержат, могут иметь любое из возможных 256-битных значений. Разделителей записей нет.
записи переменной длины (RECFM V или VB (VBS — Varible Blocked Spanned, который представляет собой нечто иное, чем простая запись) имеют префикс из четырех байтов (слово дескриптора записи (RDW)), первые два из которых указывают длину запись.Таким образом, они содержат управляющую информацию и данные. Разделителей записей нет (потому что вместо этого известна длина).
Блоки для набора данных VB также имеют префикс слова дескриптора блока (BDW), четыре байта, первые два из которых содержат длину блока.
Данные записываются и читаются только блоками, при этом снятие блокировки выполняется подпрограммами io. Чем больше размер блока, тем меньше ios. Однако, поскольку максимальный размер блока меньше размера дорожки на диске, наиболее эффективной блокировкой является «блокирование половинной дорожки» с размером блока до одной записи, меньшим 27 998 или равным ему.
Записи с фиксированным блоком имеют меньше накладных расходов, потому что единственная информация (размер блока (BLKSIZE) и максимальная длина записи (LRECL) предоставляется (в каталоге, JCL или программой, особенно если они написаны на Ассемблере), а не хранится в данных.
Для записей переменных блоков существует два типа управляющей информации (BDW и RDW), встроенной в данные, а также другая информация.
Программисту мэйнфрейма не нужно много знать об этом.Программа будет иметь дело с записями, детали блокировки могут быть внешними по отношению к программе.
Вот блок FB:
DATADATADATADATA
То, как этот блок разбивается на записи фиксированной длины, хранится вне данных. Положение третьей записи в блоке можно вычислить. Этот факт используется в низкоуровневом методе доступа.
Вот блок VB:
BDWRDWDATARDWDATARDWDATA
Позиция третьей записи в блоке известна только тем записям, которые до нее были обработаны подпрограммами io.
Выбор неправильного типа, неправильной длины записи или неправильного размера блока может значительно повлиять на производительность программы.
Когда данные передаются с мэйнфрейма, есть опции для удаления RDW (если он есть), вставки разделителей, удаления завершающих пробелов и тому подобного, чтобы данные теперь выглядели как собственный файл. Передача на мэйнфрейм происходит в обратном порядке.
Если вы собираетесь получать данные от мэйнфрейма или отправлять данные на мэйнфрейм, делайте это только в символьном формате.Никаких «двоичных» или «упакованных» полей и использование явных знаков, явных десятичных знаков или коэффициентов масштабирования. Вы сэкономите себе столько хлопот и попадете в хорошие книги аудиторов.


 Причем полуметровая высота бывает только у блоков с шириной от двух метров.
Причем полуметровая высота бывает только у блоков с шириной от двух метров. Он играет в нём роль своеобразного армирующего наполнителя.
Он играет в нём роль своеобразного армирующего наполнителя.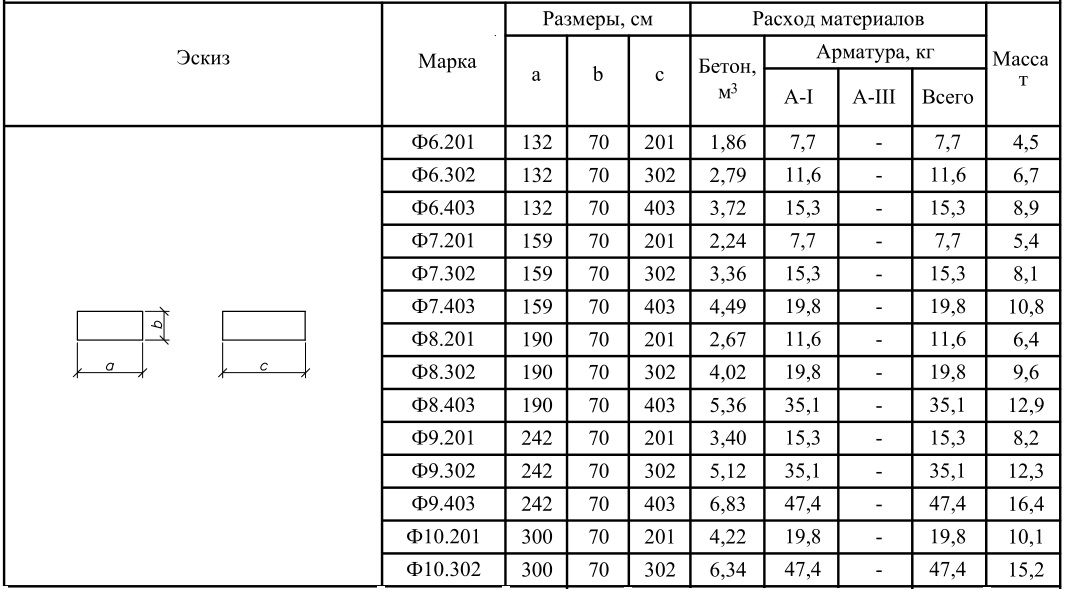 Объясняется это тем, что становится возможным ускорение хода возведения фундамента. Самым большим блоком ФБС для основания является такое изделие, которое по своим параметрам способно заполнить практически одну четвёртую часть десятиметровой стены, выполненные из ленточного основания. Таким образом, с целью возведения фундамента мелкозаглублённого типа потребуется наличия всего лишь на всего шестнадцати единиц рассматриваемого изделия. В том случае, если основание планируется погрузить глубоко, то его необходимо будет сложить из тридцати двух блоков. Они складываются из двух рядов.
Объясняется это тем, что становится возможным ускорение хода возведения фундамента. Самым большим блоком ФБС для основания является такое изделие, которое по своим параметрам способно заполнить практически одну четвёртую часть десятиметровой стены, выполненные из ленточного основания. Таким образом, с целью возведения фундамента мелкозаглублённого типа потребуется наличия всего лишь на всего шестнадцати единиц рассматриваемого изделия. В том случае, если основание планируется погрузить глубоко, то его необходимо будет сложить из тридцати двух блоков. Они складываются из двух рядов.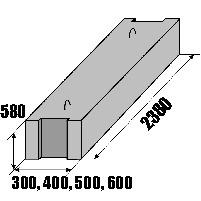
 При укладке сплошных блоков используется принцип «от угла к центру». Швы должны быть заполнены посредством специализированного скрепляющего раствора.
При укладке сплошных блоков используется принцип «от угла к центру». Швы должны быть заполнены посредством специализированного скрепляющего раствора.