Как найти объем раствора 🚩 масса раствора формула 🚩 Естественные науки
Автор КакПросто!
Существует несколько формул для нахождения объема раствора. В зависимости от того, что дано в условии задачи, можно выбрать одну из них. Порой данных в задаче недостаточно, и приходится применять дополнительные формулы для их нахождения.
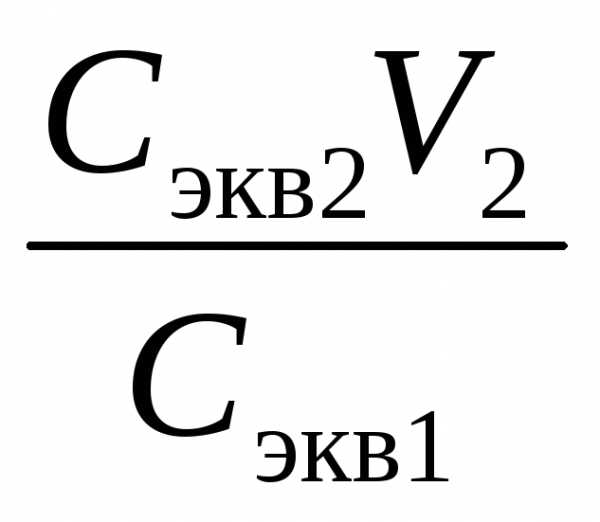
Статьи по теме:
Инструкция
Одна из наиболее часто используемых формул выглядит так: V = m/p, где V — объем, m — масса(г), p — плотность(г/мл). Соответственно, если даны эти величины, можно без труда найти объем. Иногда бывает так, что не дана масса вещества, но дано количество вещества (n) и указано, какое это вещество. В этом случае массу находим по формуле: m = n*M, где n — количество вещества (моль), а M — молярная масса(г/моль). Лучше всего рассмотреть это на примере задачи. Количество вещества раствора сульфата натрия равно 0,2 моль, а плотность — 1,14 г/мл, найти его объем.Сначала пишем основную формулу для нахождения объема: V = m/p. Из этой формулы по условию задачи мы имеем только плотность (1,14 г/мл). Находим массу: m = n*M. Количество вещества дано, осталось определить молярную массу. Молярная масса равна относительной молекулярной массе, которая в свою очередь складывается из относительных атомных масс простых веществ, входящих в состав сложного. На самом деле все просто: в таблице Менделеева под каждым веществом указывается его относительная атомная масса. Формула нашего вещества Na2SO4, считаем. M (Na2SO4) = 23*2+32+16*4=142 г/моль. Подставляем в формулу, получаем: m = n*M = 0,2*142 = 28,4 г. Теперь полученное значение подставляем в общую формулу: V = m/p = 28,4/1,14 = 24,9 мл. Задача решена.Бывают еще другие типы задач, где присутствует объем раствора – это задачи на концентрации раствора. Формула, необходимая для нахождения объема раствора, выглядит так: V = n/c, где V – объем раствора(л), n – количество растворенного вещества(моль), c – молярная концентрация вещества(моль/л). При необходимости найти количество растворенного вещества, это можно сделать по формуле: n = m/M, где n – количество растворенного вещества(моль), m – масса(г), M – молярная масса(г/моль).
Обратите внимание
Единицы измерения данных величин должны соответствовать друг другу. Например, если масса дана в кг, то соответствующий ей объем измеряется в литрах. А если масса в г, то объем в мл.
Полезный совет
Всегда внимательно читайте условие задачи. Порой из-за неправильно прочитанного условия можно не решить даже самую легкую задачу.
Источники:
- «Сборник задач по химии», Г.П. Хомченко, И.Г. Хомченко, 2002.
- определить объем раствора
www.kakprosto.ru
Концентрация раствора — Знаешь как
Содержание статьи
Весовая процентная концентрация показывает, какой процент от общего веса раствора составляет растворенное вещество.
■ 18. Сколько нитрата калия нужно взять для приготовления 300 г 2% раствора соли?
19? Сколько воды и сахара требуется для приготовления 250 г 10% раствора?
20. Сколько хлорида бария потребуется для приготовления 50 г 0,5% раствора? (См. Ответ)
В лабораторной практике часто приходится иметь дело с кристаллогидратами — солями, содержащими кристаллизационную воду, например CuSО4 ·5H2O, FeSО4 · 7H2О и т. д. В этом случае следует уметь учитывать кристаллизационную воду.
Пример 1. Сколько соли нужно для приготовления 500 г 3% ее раствора? | |
Дано: 500 г. 3% раствора соли | Если сказано, что имеется 3% раствор, это значит, что в любом количестве этого раствора содержится 3% соли. Чтобы рассчитать, сколько нужно соли для приготовления 500 г такого раствора, следует найти 3% от 500 г: (500 · 3) : 100 = 15г Следовательно, соли нужно 15 г, а воды 500— 15 = 485 г. |
Пример 2. Сколько кристаллогидрата медного купороса нужно взвесить, чтобы получить 200 г 5% раствора сульфата меди? Сколько воды нужно для этого взять? | |
Дано: 200 г 5% CuSO4 | Решение: Сначала требуется определить, сколько сульфата меди CuSО4 нужно для приготовления заданного количества раствора: (200 · 5) :100 = 10 г. CuSO4. Далее делаем пересчет на кристаллогидрат: грамм-молекула CuSO4 весит 160 г, а грамм-молекула CuSO 4 · 5H2О весит 250 г. Следовательно, мы можем составить пропорцию: 160 г CuSO4— в 250 г CuSO4 · 5H2О 10» CuSО4 — » х » CuSO4· 5Н2О X=(250 · 10) : 160 = 15,625 г. Воды для приготовления раствора требуется 200— 16,6 15= 184,375 г. |
■ 21. Сколько кристаллогидрата Na2SO4 · 10H2O понадобится для приготовления 2 кг 34 раствора Na2SО4?
22. Сколько кристаллогидрата железного купороса FeSO4·7h3O потребуется для приготовления 30 кг 0,5% раствора FeSO4?
23. Сколько кристаллогидрата CaCl2 · 6H2O потребуется для приготовления 500 г 10% раствора СаСl2?
24. Сколько кристаллогидрата ZnSO4· 7H2O потребуется для приготовления 400 г 0,1 % раствора ZuSО
Иногда приходится приготовлять растворы определенной процентной концентрации, пользуясь для этого другими, более концентрированными растворами. Особенно часто с этим приходится сталкиваться в лаборатории при получении растворов кислот разной концентрации.
Пример 3. Сколько требуется 80% серной кислоты для приготовления 200 г 10% раствора этой кислоты?. Обозначим массу первого раствора m1, массу второго — m2, концентрацию первого раствора С1, концентрацию второго раствора C2. | |
Дано: m1 = 200г C1 = 10% C2 = 80%
| Прежде всего нужно выяснить, сколько чистой безводной серной кислоты потребуется для приготовления 200 г. 10% раствора: (200 · 10) : 100 = 20 г. Определяем, в каком количестве 80% серной кислоты содержится 20 г чистой кислоты, рассуждая так: в 100 г 80% H2SО4 — 80 г чистой H2SО4 » х » 80% H2SО4 —20 » »H2SО4. Отсюда х = (100 · 20) : 80 = 25 г 80% раствора. Следовательно, для нашей цели нужно 25 г 80% раствора H2SО4 и 200—25 = 175 г воды. |
■ 25. Сколько потребуется 80% фосфорной кислоты для приготовления 2 кг 5% раствора?
26. Сколько потребуется 20% щелочи для приготовления 5 кг. 1 % раствора?
27. Сколько потребуется 15% азотной кислоты для приготовления 700 г 5% раствора?
28. Сколько потребуется 40% серной кислоты для приготовления 4 кг 2% раствора?
29. Сколько потребуется 10% соляной кислоты для приготовления 500 г 0,5% раствора? (См. Ответ)
Обратимся снова к примеру 3, приведен ному на стр 67. Из таблицы (приложение III, п. 3, стр. 394) видно, что 80% серная кислота имеет плотность d=1,7, а масса раствора Р =25 г. Следовательно, по формуле
V = P : d находим: V = 25 : 1,7 = 14,7 мл.
Плотность воды практически считаем равной единице. Следовательно, 175 г воды займут объем 175 мл. Таким образом, чтобы приготовить 200 г 10% раствора из 80% серной кислоты, следует взять 175 мл воды и налить в нее 14,7 мл 80% серной кислоты. Смешивание можно производить в любой химической посуде.
■ 30. Сколько миллилитров 50% серной кислоты следует взять для приготовления 2 кг 10% раствора этой кислоты?
31. Сколько миллилитров 40% серной кислоты следует взять для приготовления 5 л 4% серной кислоты?
32. Сколько миллилитров 34% едкого кали потребуется для приготовления 10 л 10% раствора?
33. Сколько миллилитров 30% соляной кислоты потребуется для приготовления 500 мл 2% соляной кислоты? (См. Ответ)
Примеры расчетов, которые мы разбирали до сих пор, были посвящены определению веса или объема раствора, а также количества вещества, содержащегося в нем. Однако бывают случаи, когда нужно определить концентрацию раствора. Рассмотрим простейший случай.
Пример 4, Рассчитайте, какова процентная концентрация раствора, если смешано 45 г воды и 5 г соли. | |
Дано: mh3O mсоли = 5г
| Решение: Сначала определяем общее количество раствора: 45 г + 5 г = 50 г. Затем определяем процентную концентрацию: (5 : 50) · 100 = 10% Следовательно раствор 10%. |
■ 34 Смешано 25 г соли и 35 г воды. Какова процентная концентрация раствора?
35. Смешано 5 г кислоты и 75 г воды. Какова процентная концентрация раствора? (См. Ответ)
Довольно часто приходится разбавлять, упаривать и смешивать растворы, после чего определять их концентрацию.
Пример 5. К 250 г 10% раствора добавили 150 г воды Какой стала концентрация раствора? | |
Дано: m1 = 250г C1 = 10% mh3O = 150г
| Решение: Сначала рассчитываем содержи ние вещества в 250 г раствора:(250 · 10) : 100 = 25 г. Определяем общее количество получившегося раствора: 250 + 150 = 400 г. Поскольку мы к раствору приливали только воду, а растворенное вещество не добавляли, то его количество осталось, очевидно, таким же. Следовательно, в 400 г полученного раствора содержится 25 г вещества, а его процентная концентрация(25 : 400) · 100 = 6,25% |
■ 36. К 2 кг 20% раствора прилили 500 г воды. Какой стала концентрация раствора?
37. К 5 а 36% соляной кислоты прилили 1 л воды. Какой стала концентрация раствора?
38. Смешали 40 кг 2% и 10 кг 3% растворов одного и того же вещества. Какой стала концентрация полученного раствора?
39. Смешали 4 л 28% серной кислоты и 500 мл 60% серной кислоты. Какова концентрация полученного раствора?
40. 3 кг 20% раствора едкого натра упарили до 2 кг. Какова концентрация полученного раствора?
41. Сколько воды нужно прибавить к 500 мл 30% раствора (плотность 1,224 г/см3), чтобы получить 5% раствор? (См. Ответ)
Для определения, в каком соотношении следует смешать растворы разных концентраций, чтобы получить раствор искомой концентрации, можно применять так называемое «правило смешивания», или «диагональную
схему»
Пример 6. В каком весовом соотношении следует смешать 40% и 15% растворы, чтобы получить 35% раствор? |
Решение. Для решения составляют диагональную схему: 40→20 \ / 35 / \ 15→5 В центре пишут искомую концентрацию. У левого конца каждой диагонали пишут данные концентрации. Затем по диагонали производят вычитание: 35—15 = 20 40 — 35 = 5 (вычитают всегда из большей величины меньшую). Результат вычитания проставляют у правого конца соответствующей диагонали. Получилось, что смешать требуется 5 в. ч. 15% и 20 в. ч. 40% раствора, т. е. в соотношении 1:4. Если в смешивании участвует вода, ее концентрация берется равной 0%. |
■ 42. Рассчитайте по диагональной схеме, в каком соотношении следует смешать растворы:
а) 20% и 3% для получения 10%;
б) 70% и 17% для получения 25%;
в) 25% и воду для получения 6% (См. Ответ)
Объемная концентрация растворов. Молярная концентрация
При определении объемной концентрации растворов расчеты производят применительно к 1 л раствора. Молярная концентрация, например, показывает сколько грамм-молекул (молей) растворенного вещества содержится в 1 л раствора.
Если вы не помните, что такое грамм-молекула, обратитесь к приложению на стр. 374.
Например, если в 1л раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1 М), если 2 моля, то двумолярным(2 М), если 0,1 моля, тo раствор децимолярный (0,1 М), если 0,01 моля, то раствор сантимолярный (0,01 М) и т. д. Для приготовления растворов молярной концентрации необходимо знать формулу вещества.
Пример 7. Сколько нужно взять едкого натра, чтобы приготовить 200 мл 0,1 М раствора едкого натра NaOH. | |
Дано: V = 200 мл С = 0,1 М | |
znaesh-kak.com
Примеры решения задач Пример 1. Какой объем 0,1 н. Раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,02 н. Раствора?
Решение.Т.к. количество молей
эквивалентов H2SO4 в исходном и приготовленном растворах
одинаково, то, в соответствии с законом
эквивалентов (7), объем исходного раствора V1 = 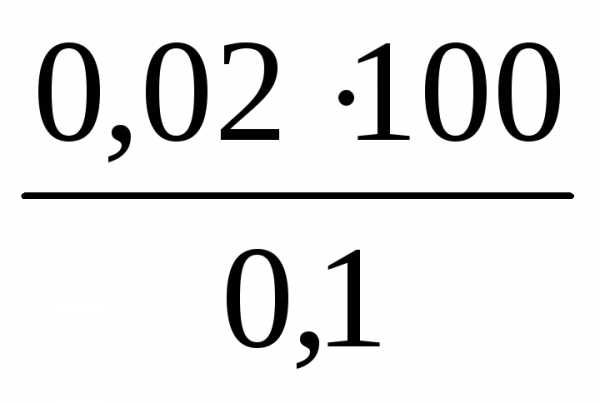 =
=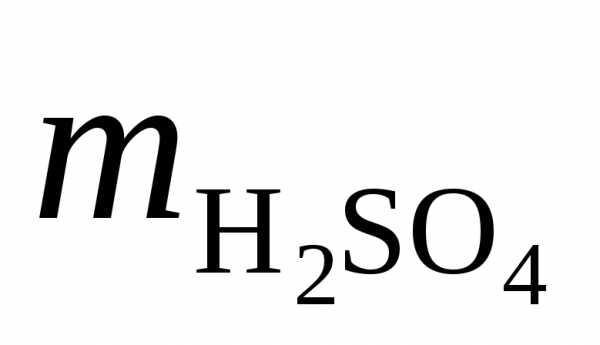 =20
мл.
=20
мл.
Пример 2. Какой объем 12%-ного раствора H2SO4 потребуется для приготовления 1 л 0,1н. раствора этой кислоты.
Решение. Масса серной кислоты в 1 л 0,1н. раствора составляет
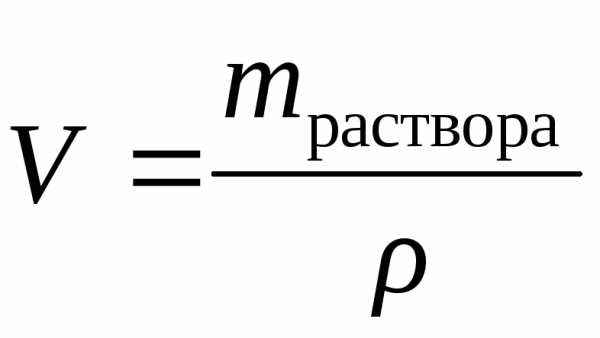 = =
490,11=4,9
г. Такая масса H2SO4 содержится в 40,83 г 12%-ного раствора в
соответствии с формулой (1):
=40,83
г.
= =
490,11=4,9
г. Такая масса H2SO4 содержится в 40,83 г 12%-ного раствора в
соответствии с формулой (1):
=40,83
г.
Плотность
исходного раствора по данным табл.3
Приложения составляет =1080,0
г/л. Следовательно, для приготовления
1 л 0,1н. раствора H2SO4 потребуется 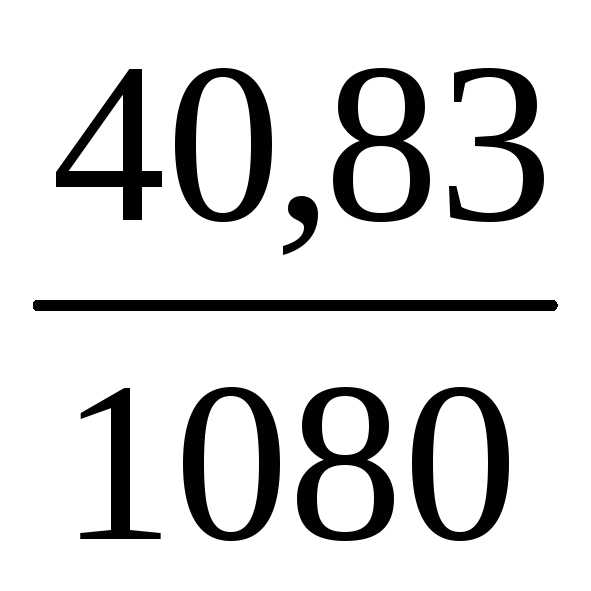 =
=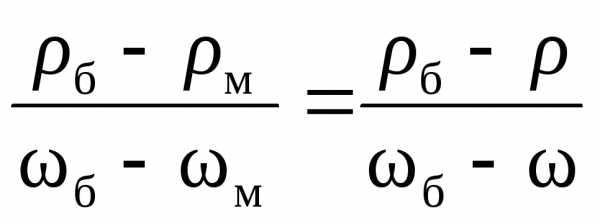 =0,0378
л или 37,8 мл 12%-ного раствора.
=0,0378
л или 37,8 мл 12%-ного раствора.
Пример 3. Плотность водного раствораNaCl = 1095,0 г/л. Определить массовую долю соли в растворе, рассчитать молярную долю NaCl, молярную концентрацию, молярную концентрацию эквивалента соли, моляльную концентрацию и массовую концентрацию раствора.
Решение. Для определения массовой доли соли в растворе используем данные табл.3 Приложения. Заданное значение плотности раствораNaClв табл.3 отсутствует, поэтому применимметод интерполяции. Для этого используем ближайшие меньшее и большее значения плотностей и соответствующие им массовые доли раствора данной соли. Считая, что в указанных пределах зависимость между плотностью и массовой долей раствора линейная, рассчитаем массовую долю растворенного веществав растворе по пропорции (индекс б означает «большее», м — «меньшее»):
 .
.
По данным табл.3 б=1100,9 г/л;б= 0,14;м=1085,7 г/л;м= 0,12. Соответственно:
.
Решая уравнение, получим =0,132 (или 13,2%).
При расчете молярной доли соли в растворе и других концентраций удобно использовать следующие соотношения: масса раствора – 100 г, следовательно, масса растворенного вещества т = 13,2г, а масса воды (растворителя)ms = 86,8 г = 0,0868 кг. В таком растворе число молей NaCl составитnNaCl==0,2256 моль, а число молей воды=4,8222 моль.
Следовательно, молярная доля NaCl в соответствии с уравнением (2), =0,045.
По уравнению (3) рассчитаем моляльную концентрацию:
Сm = =2,6
моль/кг.
=2,6
моль/кг.
Раствор
массой 100 г занимает объем V=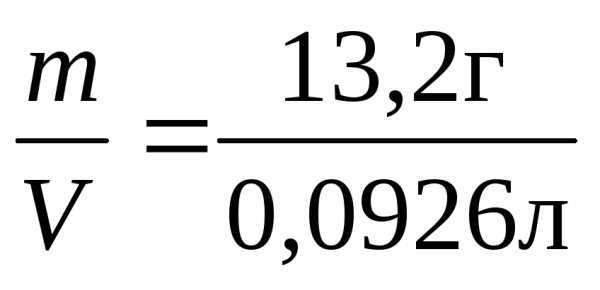 =0,0926
л, следовательно:
=0,0926
л, следовательно:
молярная концентрация по уравнению (4): С==2,48моль/л,
молярная концентрация эквивалента по (5): Сэкв==2,48 моль экв/л,
массовая
концентрация по (6):Смасс=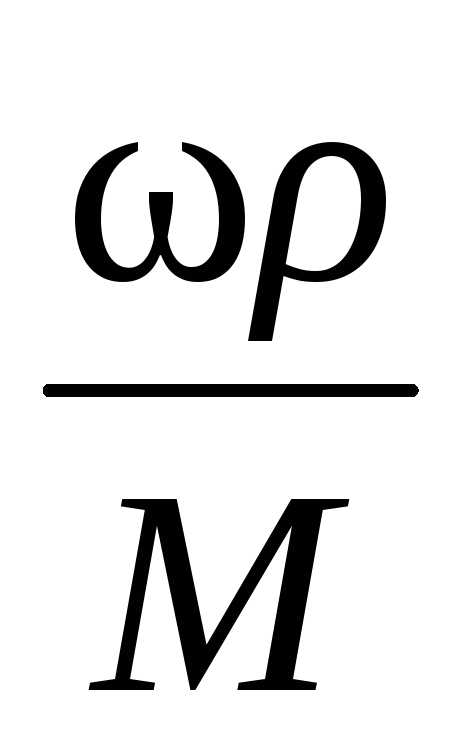 =144,54
г/л.
=144,54
г/л.
Для расчетов можно использовать и соотношения табл.1 Приложения:
1) С=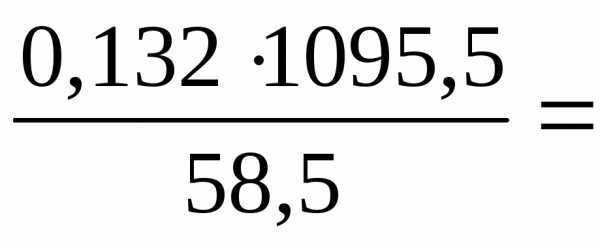 =
=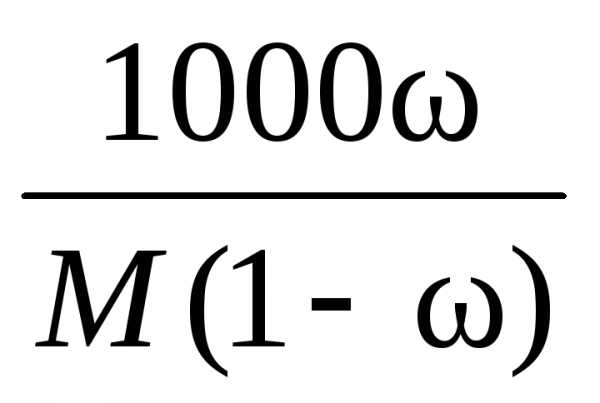 2,48
моль/л; 2)Сэкв=Сzэкв=2,481=
2,48 моль экв/л;
2,48
моль/л; 2)Сэкв=Сzэкв=2,481=
2,48 моль экв/л;
3) Сm= =
=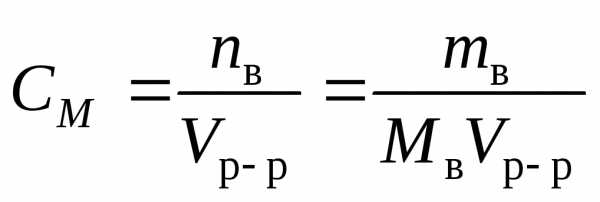 =2,6моль/кг;4)Смасс==0,1321095 =144,54 г/л.
=2,6моль/кг;4)Смасс==0,1321095 =144,54 г/л.
Контрольные вопросы и задачи для защиты лабораторной работы
1–20. Рассчитать массовую долю, молярную концентрацию, молярную концентрацию эквивалента, моляльную концентрацию и массовую концентрацию раствора данного вещества, используя значение плотности данного раствора и соответствующие величины табл.3.
№ | Раствор NaCl, г/л | № | Раствор H2SO4 , г/л | № | Раствор HCl, г/л | № | Раствор CH3COOH, г/л |
1 | 1010,0 | 6 | 1030,0 | 11 | 1015,0 | 16 | 1006,0 |
2 | 1050,0 | 7 | 1050,0 | 12 | 1035,0 | 17 | 1010,0 |
3 | 1080,0 | 8 | 1090,0 | 13 | 1055,0 | 18 | 1018,0 |
4 | 1120,0 | 9 | 1190,0 | 14 | 1080,0 | 19 | 1025,0 |
5 | 1170,0 | 10 | 1250,0 | 15 | 1125,0 | 20 | 1032,0 |
21–35. Рассчитать массу соли и объем воды, необходимые для приготовления 1 л раствора NaClзаданного состава, используя величины табл.3
№ | | № | | № | |
21 | 0,01 | 26 | 0,08 | 31 | 0,18 |
22 | 0,02 | 27 | 0,10 | 32 | 0,20 |
23 | 0,03 | 28 | 0,12 | 33 | 0,22 |
24 | 0,04 | 29 | 0,14 | 34 | 0,24 |
25 | 0,06 | 30 | 0,16 | 55 | 0,26 |
36–55. Используя данные табл.3, рассчитать объем заданного раствора, необходимый для приготовления 1 л 0,1н. раствора кислоты H2SO4 илиHCl:
№ | Концентрация | № | Концентрация | № | Концентрация | № | Концентрация |
36 | =0,350 | 41 | =0,227 | 46 | =0,262 | 51 | =0,165 |
37 | =0,326 | 42 | =0,201 | 47 | =0,243 | 52 | =0,145 |
38 | =0,302 | 43 | =0,174 | 48 | =0,223 | 53 | =0,125 |
39 | =0,277 | 44 | =0,147 | 49 | =0,204 | 54 | =0,105 |
40 | =0,252 | 45 | =0,091 | 50 | =0,184 | 55 | =0,085 |
Таблица 3.
Плотности водных растворов некоторых веществ при 20оС
NaCl | H2SO4 | HCl | CH3COOH | ||||
| , г/л | | , г/л | | , г/л | | , г/л |
0,01 | 1005,3 | 0,003 | 1000,0 | 0,004 | 1000,0 | 0,04 | 1004,1 |
0,02 | 1012,5 | 0,032 | 1020,0 | 0,024 | 1010,0 | 0,08 | 1009,8 |
0,04 | 1026,8 | 0,062 | 1040,0 | 0,044 | 1020,0 | 0,12 | 1015,4 |
0,06 | 1041,3 | 0,091 | 1060,0 | 0,064 | 1030,0 | 0,16 | 1020,8 |
0,08 | 1055,9 | 0,120 | 1080,0 | 0,085 | 1040,0 | 0,20 | 1026,1 |
0,10 | 1070,7 | 0,147 | 1100,0 | 0,105 | 1050,0 | 0,24 | 1031,2 |
0,12 | 1085,7 | 0,174 | 1120,0 | 0,125 | 1060,0 | 0,28 | 1036,0 |
0,14 | 1100,9 | 0,201 | 1140,0 | 0,145 | 1070,0 | 0,32 | 1040,5 |
0,16 | 1116,2 | 0,227 | 1160,0 | 0,165 | 1080,0 | 0,36 | 1044,8 |
0,18 | 1131,9 | 0,252 | 1180,0 | 0,184 | 1090,0 | 0,40 | 1048,8 |
0,20 | 1147,8 | 0,277 | 1200,0 | 0,204 | 1100,0 | 0,44 | 1052,5 |
0,22 | 1164,0 | 0,302 | 1220,0 | 0,223 | 1110,0 | 0,48 | 1055,9 |
0,24 | 1180,4 | 0,326 | 1240,0 | 0,243 | 1120,0 | 0,52 | 1059,0 |
0,26 | 1197,2 | 0,350 | 1260,0 | 0,262 | 1130,0 | 0,56 | 1061,8 |
studfiles.net
Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.
* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P [в % (масс.) ]. Тогда:
(I)
(2)
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
(3)
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4)
(5)
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
(6)
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
(7)
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(8)
(9)
(10)
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
(11)
Объем воды (в мл) для разбавления: b = V2 — V1
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:
Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%:
К оглавлению
см. также
www.himikatus.ru
КАКОЙ ОБЪЕМ РАСТВОРА ПОТРЕБУЕТСЯ ДЛЯ
ОЧИСТИТЕЛЬНОЙ КЛИЗМЫ ?
Во многих случаях при назначении медицинских препаратов учитывается вес пациента. Трудно не согласится с этим, ведь чем больше вес больного, тем солиднее должна выглядеть его индивидуальная лекарственная доза.
По логике вещей, то же самое следовало бы отнести и на счет очистительных клизм. Ведь чем больше по величине кишечник у больного, тем больший, при прочих равных условиях, объем воды потребуется для его промывания.
Однако в этом случае правильнее всего было бы соотнести объем очистительной клизмы не с весом человека, а с его ростом. И вот почему. Совершенно отчетливо в этой связи прослеживается следующая закономерность: чем больше рост человека, тем длиннее у него кишечник, а значит, и объем кишечника будет больше.
Даже если этот гражданин «сильно подрастет в ширину», существенно прибавив в весе, то и тогда его кишечник останется такого же размера и объема, как прежде.
Смею заверить вас, что потеря веса индивидуумом также не вызовет каких-либо заметных изменений в размерах его кишечника.
Поэтому я и считаю, что при определении объема очистительной клизмы в качестве аргумента должен быть принят рост, а не вес человека.
Но это еще не все. Чтобы действительно установить необходимый объем воды для промывания кишечника больного, следует также учесть конституциональные особенности его фигуры.
Так, при одинаковом росте у людей астенического телосложения объем внутренних органов меньше, чем у нормостеников. Для гиперстеников же этот показатель будет самый большой.
Учитывая все вышесказанное, предлагаю определять объем очистительной клизмы по формуле:
V = 1000 + Кх(Н — 100),
где V — объем очистительной клизмы в миллилитрах;
К — показатель телосложения, учитывающий конституциональные особенности человека (величина безразмерная), при этом
К = 6 для астеников;
К = 8 для нормостеников;
К = 10 для гиперстеников;
Н — рост человека в сантиметрах.
Предложенной формулой можно пользоваться, начиная с 20-25 лет, когда мы заканчиваем расти и в основном складывается наше телосложение.
Подставив в общую формулу свой рост и показатель телосложения, каждый сможет определить свой индивидуальный объем очистительной клизмы.
Например, если вы имеете астенический тип телосложения, который характеризуется высоким ростом, узкой и длинной грудной клеткой и слабой мускулатурой, и ваш конкретный рост составляет 190 см, то объем воды, который следует взять для очистительной клизмы будет определяться таким образом:
V = 1000 + 6х (190 — 100) = 1000 + 6х 90 = =1540 мл
Если вы нормостеник, т. е. имеете пропорциональное телосложение, ваш рост — 180 см, то объем воды для вашей очистительной клизмы составит:
V = 1000 + 8 х (180 — 100) = 1000 + 8 х 80 = =1640 мл
Если у вас крупное тело и хорошо развитая мускулатура при сравнительно невысоком росте, скажем, для примера 170 см, то объем воды, который потребуется для очистительной клизмы, в этом случае будет равен:
V = 1000 + 10 х (170 — 100) = 1000 +10 70 ==1700 мл.
Если у вас возникнут затруднения с определением своего типа телосложения, что особенно часто бывает у женщин, советую не расстраиваться и воспользоваться вариантом формулы, приведенным в разделе «Клизмы». Чтобы вам не сбиваться с ритма чтения и не перелистывать книгу в обратном порядке, привожу рекомендации еще раз: «Для очистительной клизмы взрослому человеку требуется обычно 1-2 литра воды».
В КАКОЕ ВРЕМЯ СУТОКЛУЧШЕ ВСЕГО ДЕЛАТЬ
ОЧИСТИТЕЛЬНУЮ КЛИЗМУ ?
Если обратиться к ритмологии, то на суточном графике ритмов человеческого организма интервал между пятью и семью часами утра (по местному времени) является тем временем, когда открывается, т. е. работает с наибольшей активностью, энергетический канал толстого кишечника.
В целительстве считается, что именно время максимальной активности биоэнергетического канала больного органа является наиболее благоприятным временем для энергетической работы с этим органом или системой организма, куда он входит. В связи с чем, казалось бы, наилучшим временем проведения очистительных клизм является период от пяти до семи часов утра. Но это не совсем так, а чаще всего совсем не так, если принять во внимание то, что многие определенные группы людей имеют существенные различия по темпераменту, стилю и образу жизни, графику работы и т. д. и т. п.
Трудно себе представить, чтобы суточные ритмы «жаворонка» совпадали по времени с ритмами «совы». По моим наблюдениям, и для тех и для других необходимо учитывать лишь последовательность «включения» энергетических каналов: после закрытия канала легких открывается канал толстого кишечника, за ним открывается канал сердца. Далее энергетические каналы открываются и закрываются в соответствующей последовательности: канал тонкого кишечника, канал почек, канал мочевого пузыря, канал перикарда, канал трех обогревателей, канал желчного пузыря, канал печени и снова канал легких.
За время этого цикла часовая стрелка дважды описывает полный круг. Не всегда при этом канал открыт ровно 2 часа, иногда чуть дольше, иногда чуть меньше. Но в любом случае привязку графика суточного энергетического цикла того или иного человека к конкретному местному времени суток более или менее точно можно сделать лишь с помощью специального медицинского оборудования или же в процессе работы пациента с опытным биоэнергетиком.
А поскольку все это слишком хлопотно, то, не мудрствуя лукаво, при определении наиболее благоприятного времени постановки клизм следует, в первую очередь, исходить не из теоретических представлений о суточной циркуляции биологической энергии в нашем теле, а, прежде всего, из наших обыденных возможностей.
Если вам приходится очень рано вставать на работу, то клизму лучше сделать после работы, обязательно отдохнув, и не раньше, чем через 1,5-2 часа после принятия пищи. Постарайтесь только, чтобы эта процедура производилась не позднее, чем за 1,5-2 часа до отхода ко сну.
И все-таки утреннее время предпочтительнее, потому что организм после ночного отдыха полон сил, а толстый кишечник максимально расслаблен. В этом случае клизму делают после дефекации и до завтрака. Но имейте в виду, что после клизмы у вас должен быть полуторачасовой запас времени до выхода из дома.
ПИТАНИЕ ВО ВРЕМЯ ОСНОВНОГО ПЕРИОДА ЧИСТКИ
ТОЛСТОГО КИШЕЧНИКА
Выполняя очистительную программу, вы по-прежнему Должны придерживаться регулярного, а при необходимости диетического питания. При этом, если позволяет состояние желудочно-кишечного тракта, для улучшения процесса вывода «грязи» из толстого кишечника предлагается следующее нехитрое «технологическое» решение — салат-«метла».
САЛАТ-«МЕТЛА» — ЗАЧЕМ ОН НУЖЕН И КАК ЕГО ПРИГОТОВИТЬ
Почему салату дано такое, скажем, не совсем кулинарное название, совсем нетрудно догадаться, поскольку приготовленный определенным образом овощной салат станет чем-то вроде метлы, выметающей всю грязь из толстого кишечника в процессе его чистки.
Поэтому, в первую очередь, в нем нас интересует не пищевая ценность и гастрономические изыски, а его очистительная функция.
Салат-«метла» готовится из свежей капусты, моркови и свеклы в соотношении 3:1:1. Салат не солят. Капусту шинкуют, а морковь и свеклу натирают на крупной терке. Все это тщательно перемешивают и мнут руками до выделения сока. Можно добавить в салат немного лимонного сока. Такой салат готовят себе те, кто не страдает заболеваниями желудка, это прежде всего те, у кого кислотность желудочного сока в норме. Салат заправляют любым растительным маслом, кроме оливкового.
Тем же, у кого кислотность желудочного сока понижена, я рекомендую в салате использовать не свежую, а квашеную капусту. Лимонного сока можно добавить несколько больше. Больным с анацидным гастритом, у которых в желудочном соке полностью отсутствует соляная кислота, также советую использовать в салате квашеную капусту и маринованную свеклу. Салат следует обильно заправить лимонным соком и любым растительным маслом, кроме оливкового.
А вот для лиц, страдающих избытком соляной кислоты в желудочном соке, свеклу, перед тем как натереть, предварительно отваривают. Соотношение между свежей капустой, морковью и свеклой в этом случае будет 1:1:2. В салат для усиления перистальтики кишечника можно добавить также мелко нарезанный, предварительно размоченный чернослив. Салат также следует заправить растительным маслом. В этом случае можно использовать и оливковое масло, но цитрусовые соки вводить в такой салат нельзя.
ЗАКЛЮЧИТЕЛЬНЫЙ ПЕРИОД «МЕДОВОЙ» ЧИСТКИ ТОЛСТОГО КИШЕЧНИКА
Заключительный период составляет 5-7 дней после проведения последней клизмы. Учитывая то, что в течение основного периода чистки мы все время помогали толстому кишечнику опорожняться, естественно, он не сможет сразу же настроиться на четкую и бесперебойную работу.
Таким образом, целью заключительного периода является нормализация работы толстого кишечника после окончания клизмования. Очень важно добиться того, чтобы в это время не было задержки стула.
Поэтому рекомендуется: в течение недели применять медотерапию;
А в течение 3-4 дней придерживаться пищи растительного происхождения;
стараться вести активный образ жизни;
если в течение 2-3 дней не будет стула, нужно принять легкое слабительное;
А если стула нет в течение суток и после приема слабительного, нужно сделать очистительную клизму.
Но скорее всего ни слабительное, ни тем более клизмы вам не понадобятся, потому что хорошо очищенный кишечник не нуждается в такого рода помощи.
infopedia.su
Приготовление раствора | Задачи 431
Задача 431.
Найти массу воды, необходимую для приготовления раствора хлорида натрия, содержащего 1,50 моля NaCl на 1000 г Н2О, если имеется 10 г NaCl?
Решение:
Находим массу хлорида натрия, содержащуюся в 1000 граммах воды по формуле:
где
n(B) — количество вещества, m(B) — масса вещества, M(B) — молярная масса вещества.
Тогда
m(NaCl) = n(NaCl) .M(NaCl) = 1,5 . 58,5 = 87,75 г.
Тогда масса раствора составит: 1000 + 87,75 = 1087,75г.
Рассчитаем массовую долю хлорида натрия по формуле:
,
где
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
Исходя из того, что для приготовления 8,067%-ного раствора взято 10 г NaCl, можно рассчитать массу раствора:
Зная общую массу раствора [m(р-ра) = 124г] и массу вещества [m(B) = 10г], находим массу воды:
m(р-ра) = m(B) + m(растворителя);
m(Н2О) = m(p-pa — m(NaCl) = 124 — 10 = 114 г.
Ответ: 114г.
Задача 432.
Какой объем 2н. раствора h3SO4 потребуется для приготовления 500 мл 0,5н. раствора?
Решение:
Определим молярную массу эквивалента h3SO4 из соотношения:
MЭ(В) — молярная масса эквивалента кислоты, г/моль; М(В) — молярная масса кислоты; Z(B) — эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 → 2.
Отсюда
Найдём массу H2SO4 в 500 мл 0,5н раствора по формуле:
где
m(B)- масса растворённого вещества, MЭ(В) — молярная масса эквивалента растворённого вещества, V – объём раствора (в л или мл).
Тогда
Рассчитаем, какой объём 2н. раствора H2SO4 потребуется для приготовления 500 мл 0,5н, используя выше приведённое уравнение, получим:
Ответ: 125мл.
Задача 433.
Какой объем 0,05н. раствора можно получить из 100 мл 1н. раствора?
Решение:
Количество эквивалентов вещества в исходном растворе будет равно 0,1 (1 . 100 = 0,1). Обозначим общий объём раствора как (0,1 + х). Тогда количество эквивалентов в полученном растворе можно записать как 0,05(0,1 + х). Поскольку общее количество эквивалентов вещества равно 0,1, то можно записать: 0,05(0,1 + х) = 0,1. Тогда расчетное значение x, получим: 0,005 + 0,05х = 0,1; х = 1,9. Значит, из 100 мл 1н раствора можно получить 2 литра 0,05н раствора (0,1л + 1,9л = 2л).
Ответ: 2л.
Задача 434.
Какой объем 2М раствора Na2CO3 надо взять для приготовления 1 л 0,25 н раствора?
Решение:
Обозначим нужный объём 2М раствора через х. Тогда общее количество молей Na2CO3 будет составлять 2х. Учитывая, что эквивалентная масса Na2CO3 в 2 раза меньше молярной, то общее количество эквивалентов вещества можно записать как 2 . 2 = [4]. Поскольку общее количество эквивалентов Na2CO3 в растворе должно быть равно 0,25, то можно записать:
4x — 0,25
Тогда
Ответ: 62,5 мл.
buzani.ru
